Kemia 4 (MImm)
Etikkahappopitoisuus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
Raudan jalostus K2022
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
Ke4 - Keraamit ja komposiitit jakso 5 2021
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
Raudan jalostus KE4 5.jakso 2021
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
Ke4 - 2021 Keraamit ja komposiitit
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
KE4 - 2021 Raudan valmistus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
Palautus. HUOM! Sulkeutuu klo 12.00
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
18.5. Kappaleen 5 välitesti
Muovitehtävän palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
13.5. ja 14.5. - Polymeerit
1. Miksi kodin muovijätteen kierrättäminen on käytännössä vaikeaa?
2. Miksi kodin muovijäte kannattaa lajitella erilleen muusta jätteestä?
3. Mitä muoveja muovijätteeseen ei saa laittaa?
4. Miten muovijäte hävitetään polttamalla?
5. Mitä muoveista ei saa hävittää polttamalla? Miksi?
6. Mitä tarkoittavat merkinnät PE-LD ja PE-HD?
7. Etsi kotoasi seuraavasti muoveista valmistettuja tuotteita mitä löysit?
1. Polyeteeni high density
2. Polyeteeni low density
3. Polystyreeni
4. Polypropeeni
5. Polyvinyylikloridi
8. Mitä tarkoittaa polymeroituminen.
9. Mitä tarkoittaa polymeeri.
10. Millaisia ominaisuuksia on suoran polymeerin muodostamalla muovilla?
11. Miten ominaisuudet muuttuvat, kun ketjuun lisätään haaroja?
12. Mitä tarkoitetaan mikromuoveilla?
13. Millaisia ongelmia mikromuoveista voi syntyä?
14. Miten biomuovit eroavat öljypohjaisista muoveista?
15. Millaisiin tuotteisiin biomuovit sopivat?
16. Miksi kaikkea muovia ei korvata biomuovilla?
Näissä voi olla sen verran paljon tekemistä että käytetään kaksi kertaa, eli palautus olisi pe klo 21.
Suosittelen kokeellisen kemian kurssia KE6. Osa tosin tästäkin porukasta taitaa olla käynyt sen jo.
tehtävän 5.17 palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
11.5.2020 - Polymeerit
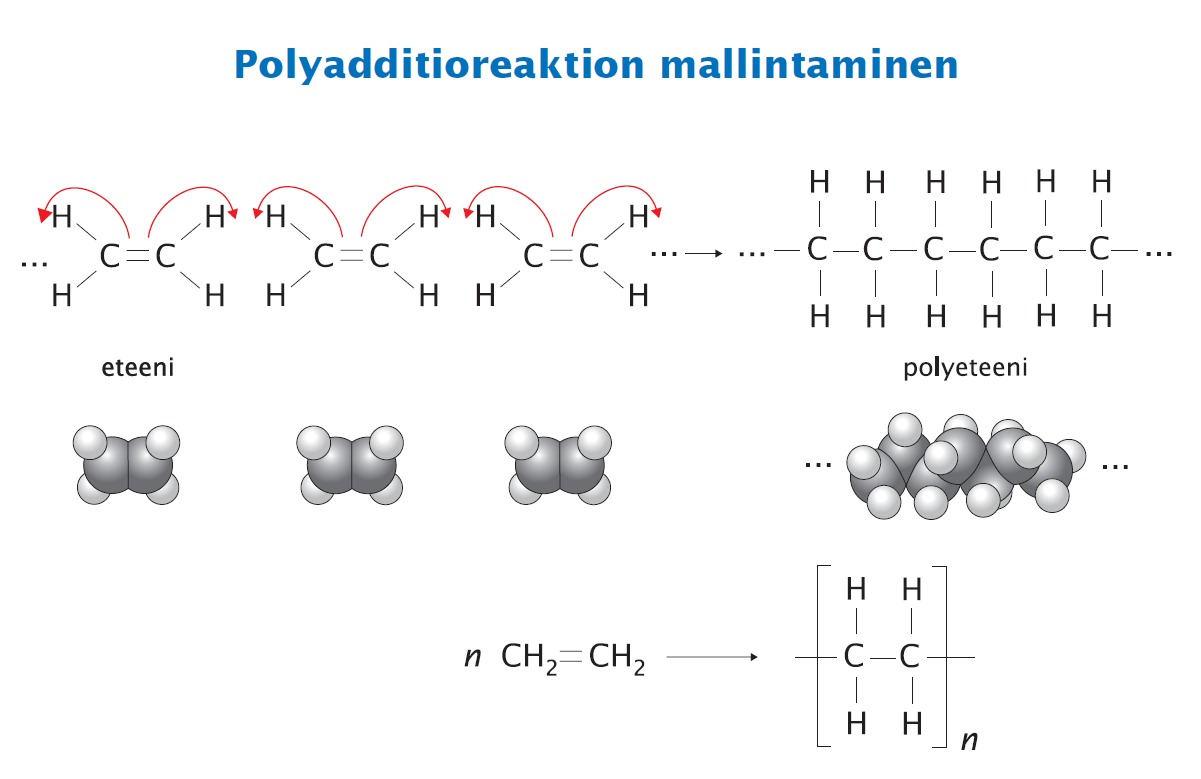
- Muodostuvat monomeereistä polyadditiolla tai polykondensaatiolla
Voidaan luokitella vaikka seuraavasti:
-
Polymeerit
-
Synteettiset polymeerit
-
Additiopolymeerit
Esim.-
Polyeteeni
-
Polypropeeni
-
-
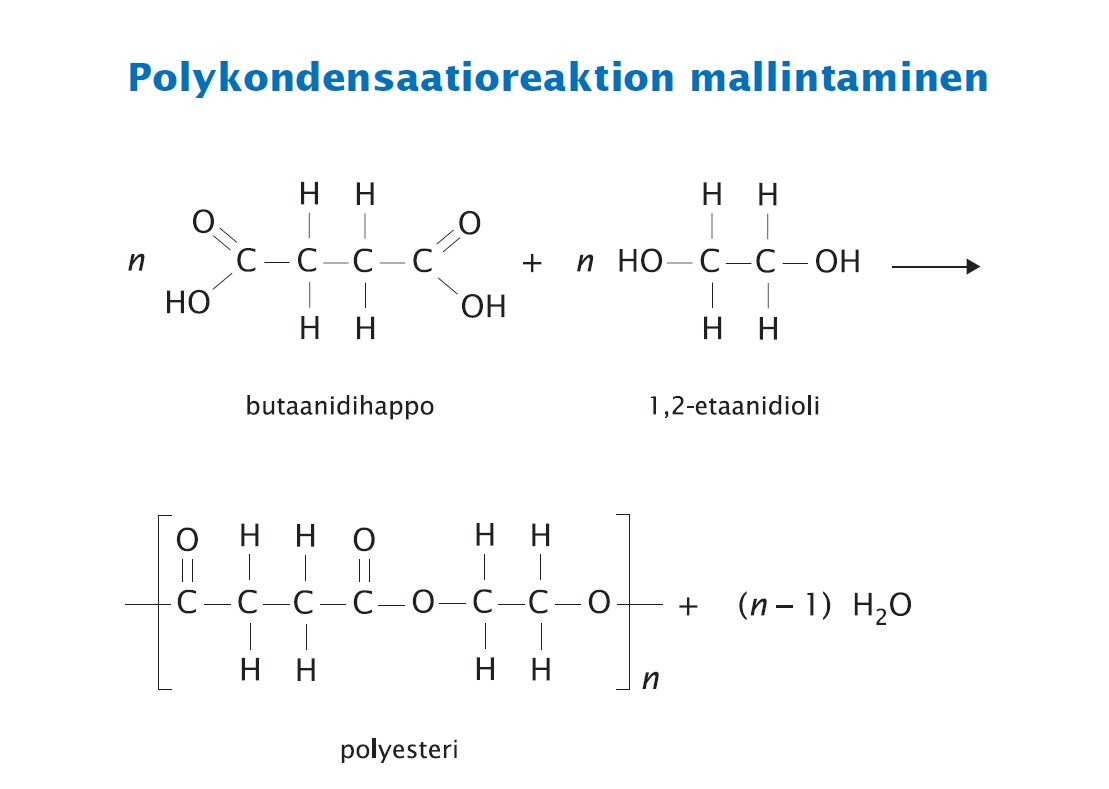
Kondensaatiopolymeerit
-
Polyesterit
-
Polyamidit
-
-
-
Biopolymeerit
-
Polysakkaridit eli hiilihydraatit (vedyn ja hapen suhde sama kuin vedessä eli noin 2:1)
-
Tärkkelys
-
Selluloosa
-
-
Polypeptidit eli proteiinit
-
Insuliini
-
Amylaasi
-
-
Polynukleotidit eli nukleiinihapot
-
DNA
-
RNA
-
-
-
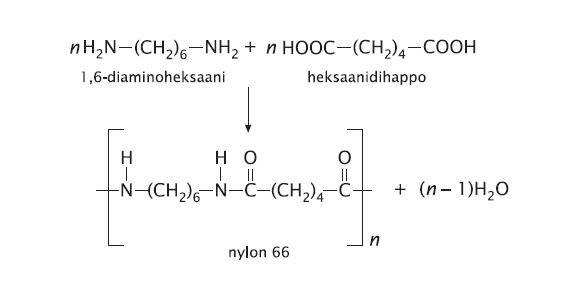
Huom! Polyamidien kauppanimi on nylon; vaikkapa nimi nylon 66 tulee siitä että amidisidoksen molemmin puolin on 6 hiiliatomia. Biopolymeereistä proteiineilla on samanlainen rakenne mutta ne eivät muodostu diamiineista ja dihapoista vaan aminohapoista joissa monomeereissä on toisessa päässä aminoryhmä ja toisessa päässä happoryhmä. Kahden alfa-aminohapon muodostamaa sidosta kutsutaan biologiassa peptidisidokseksi, mutta kemiassa kannattaa käyttää amidisidos-nimitystä sekä biopolymeereissä että synteettisissä polymeereissä.
Polyadditioreaktion kirjoittaminen tietokoneella ei ole ihan helppo joten kannattaa harjoitella ainakin kerran.
Esim. 5.12b Marvinsketch
Ensin monomeeri ja tekstityökalulla niitä n kertaa...

Sitten reaktionuoli ja kaksoissidos auki ja hiilet niistä eteenpäin...

Ryhmätyökalulla tästä polymeeri...


Tähän luultavasti löytyy jostain paljon parempaakin youtube-ohjetta jos kaivelee mutta noin se ainakin onnistuu joten kuten.
Huom! Tässä syntyvä PVC-muovi ei sovi poltettavaksi koska palatuotteena syntyy hiilidioksidin ja veden lisäksi myös vetykloridia eli suolahappoa.
Lue kirjan kappale viisi ja tee tehtävät:
5.15, 5.17(palautettava) ja 5.18
opetus.tv:n video aiheesta: https://www.youtube.com/watch?v=sLjG0x1t37k&feature=emb_logo
7.5. Kappaleen 4 välitesti
Materiaalien ominaisuuksien vertailua - palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
6.5.2020 - Keraamit ja komposiitit
Lue kirjasta mitä ovat keraamit ja mitä komposiitit. Esittele millaisia tuotteita nykyään valmistetaan keraameista ja mitä komposiiteistä. Tee taulukot
jossa vertaat millä tavalla kyseisen tuotteen ominaisuudet muuttuisivat jos ne valmistettaisiin metallista, puusta, muovista. Valitse kyseiselle tuotteelle muutama keskeinen ominaisuus kuten hinta, kulutuskestävyys, lämmönkestävyys jne.
Kuulostaa äkkiseltään vähän hoopolta mutta ylioppilastutkintolautakunta on enenevissä määrin ruvennut kysymään ominaisuuksien vertailua; taulukon tekeminen tuotteen ominaisuuksista on erittäin hyvä tapa tehdä tämä vertailu. Nyt opetellaan siis se tekemällä kaksi taulukkoa. Keraamiselle tuotteelle ja komposiittituotteelle ja verrataan ominaisuuksia puisiin, metallisiin ja muovisiin vastaaviin tuotteisiin.
Raudan jalostus - palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
4.5.2020 - Erilaisia materiaaleja
Aloita lukemalla kappaleet 4.1 ja 4.2 - metallien ominaisuuksia. Metalleihin tutustumista syvennetään nyt sitten vähän suuremmalla kirjallisella työllä
s.128 Ota selvää tehtävä: Kuinka rautaa valmistetaan luonnossa esiintyvistä rautamalmeista ja millaisia lejeerinkejä raudasta valmistetaan eri käyttötarkoituksiin? Lisää tuotokseesi kaavioita, kuvia ja kemiallisia reaktioita.
- Avainsanoina hematiitti, magnetiitti, masuuni
- Selvitä jalostukseen liittyvät kemialliset reaktiot
- Sopiva pituus noin 1,5-2 sivua, riippuen kuinka paljon ja suuria kuvia käyttää
- Jos suinkin saat lähteeksi muuta kuin wikipedian niin käytä mieluummin sitä, koeta ainakin lisäksi löytää joku muu lähde. Wikipediasta tosin löytyy melko suoraan koko juttu.
- Aikaa palauttaa keskiviikkoon klo 21.00 (On aika tiukka mutta ihan tarkoituksella tällä kertaa, voi sitten anoa lisää perustellusta syystä)
30.4.2020 - puolivälin itsearvionti
tehtävän 3.9 palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
29.4.2020 - Seoslaskut
Ensimmäisessä tapauksessa riittää tehdä reaktioyhtälö tuotteen muodostumisesta ja ratkaista lähtöaineen määrä tämän perusteella. Jos reaktioyhtälön muodostaminen ei onnistu, voidaan stoikiometriset kertoimet tuotteelle ja lähtöaineelle päätellä myös ilman reaktioyhtälöä.
Jos tuotetta syntyy useammasta lähtöaineesta (käytännössä kahdesta), on tehtävä reaktioyhtälö erikseen jokaiselle lähtöaineelle. Tämän jälkeen valitaan muuttujat ja ratkaistaan lähtöaineiden määrät. Esimerkkeinä kummatkin tapaukset.
3.8 Kiinteä hopeanitraatti sisälsi epäpuhtautena natriumnitraattia. Kun 3,012 grammaa tätä seosta liuotettiin veteen ja seokseen lisättiin ylimäärin natriumkloridiliuosta, hopeaionit saostuivat hopeakloridina. Kun saostuma suodatettiin, kuivattiin ja punnittiin, sen massaksi saatiin 2,466 g. Mikä oli epäpuhtautena olevan natriumnitraatin osuus massaprosentteina?

3.12 Metalliseos sisältää sinkkiä ja alumiinia, jotka reagoivat happojen kanssa vetykaasua vapauttaen. Kun metalliseoksesta otettiin 1,00 g:n näyte ja sen annettiin reagoida rikkihapon kanssa, vapautui 84,0 milligrammaa vetykaasua. Kuinka monta grammaa alumiinia oli seoksessa?
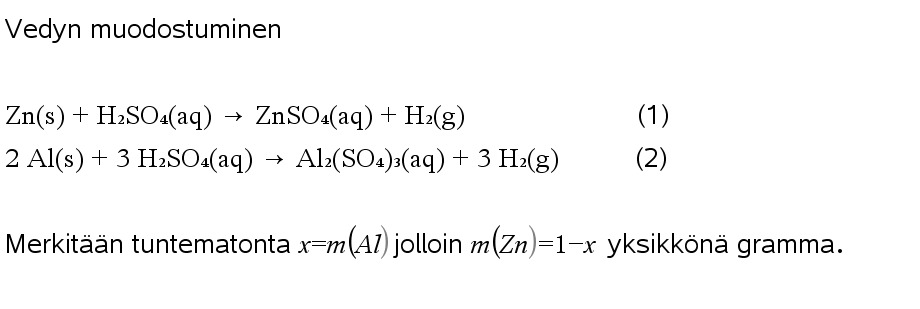

Harjoitukset melko vaativia 3.9 (palautettava, olkoon palautusaika tämän viikon loppuun kun on vappu ja kaikkea) ja 3.13.
Ohjeita: Tehtävässä 3.9 voi olla hankala muodostaa reaktioyhtälöä mutta siitä voi selvitä ilmankin. Tehdään ensin malli tilanteesta

Sitten aletaan purkamaan lopusta alkuun päin. Ensin muodosta neutraloitumisreaktion yhtälö ja laske suolahapon kulutuksen perusteella ammoniakin ainemäärä. Päättele sitten ammoniakin ja ammoniumsulfaatin ainemäärien suhde ja ratkaise kuinka paljon näytteessä oli ammoniumsulfaattia. Muuta massaksi ja vastaa kysymykseen.
Ohje 3.13: tulos oli muistaakseni väärin kirjassa. Saatko 2,04457g.
Opetus.tv:n video: https://opetus.tv/kemia/ke3/seoslasku/
tehtävän 3.1 palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
27.4.2020 - Reaktiosarjat


Harjoituksia 3.1(palautettava) ja 3.2
ja kympin jahtaajille 3.3
opetus.tv:n matskua: https://opetus.tv/kemia/ke3/reaktiosarja/
23.4. - Välitesti kappaleesta 2
Tehtävän 2.40 palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
22.4.2020 - Elektrolyysin kvantitatiivinen tarkastelu

Tästä suureyhtälöstä ratkaistaan sitten sopiva suure. Joskus siihen voi tulla pieniä mutkia kuten n=m/M, mutta yleisesti ottaen jos sähkökemiasta pitää lukiossa jotain laskea niin aika kauan tuota pyörittelisin.
Esimerkkeinä kirjasta 2.39a

2.42

Ja ytl:n tehtävä vähän vaikeampana

opetus.tv:n videoita: https://opetus.tv/kemia/ke4/elektrolyysilasku/
Harjoituksina 2.40 (palautettava), 2.43
Syventävänä niille jotka haluaavat sen kympin osaamisen 2.46
tehtävän 2.30 palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
20.4.2020 - Elektrolyysin teoria
Galvaanisessa kennossa spontaani hapetus-pelkistysreaktio saa aikaan sähkövirran. Elektrolyysissä sähkövirta aiheuttaa hapetus-pelkistysreaktion. Kannattaa jo heti alkuun kiinnittää huomio että elektrolyysi suoritetaan tässä yhdessä kennossa kun galvaanisessa kennossa kennoja oli kaksi.
Elektrolyyseistä pitäisi hallita kolme eri tapausta:
1) Suolan sulatteen elektrolyysi passiivisilla elektrodeilla.
2) Suolan vesiliuoksen elektrolyysi passiivisilla elektrodeilla.
3) Esineen päällystäminen metallilla tai metallin puhdistaminen käyttämällä aktiivisia elektrodeja.
Passiivinen elektrodi tarkoittaa sähkönjohdinta kennossa joka ei osallistu reaktioon (tyypillisesti hiili tai platina). Aktiivinen elektrodi voi olla vaikkapa kultasauva päällystettäessä koruja ohuella jalometallikerroksella tai sinkki jos halutaan päällystää rautaesine korroosiolta suojaavalta kerrokselta.
Tapauksessa 1) kationit (positiiviset ionit) pelkistyvät jännitelähteen negatiiviseen napaan kiinnitetyllä elektrodilla (katodi) ja anionit (negatiiviset ionit) hapettuvat positiiviseen napaan (anodi) kiinnitetyllä elektrodilla. Kannattaa huomata että tämä vaatii paljon energiaa ja korkeita lämpötiloja että suola voidaan sulattaa.

Tapauksessa 2) on huomioitava että elektrodilla voi reagoida vesi tai suola. Se mitä ainetta anodilla ja katodilla muodostuu riippuu reagoivien aineiden normaalipotentiaaleista. Korkeamman potentiaalin omaava reaktio tapahtuu. Huom! Tapauksissa jossa normaalipotentiaalit ovat lähellä toisiaan (kloridi-ionit ja vesi) tapahtuu molemmat reaktiot ja suolan konsentraatio vaikuttaa siihen kuinka paljon kumpaakin ainetta syntyy.
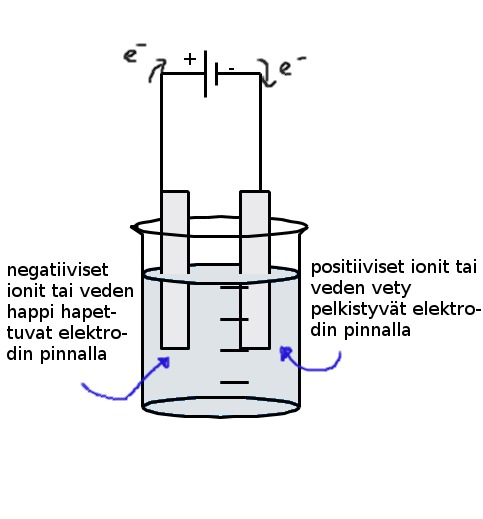
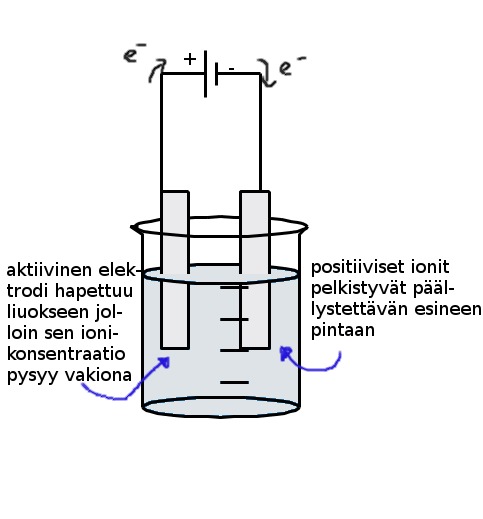
Tapauksessa 3) päällystettävä esine kiinnitettään jännitelähteen negatiiviseen napaan ja liuokseen laitetaan päällystävän aineen ioneita. Positiiviseen napaan kytketään päällystävän aineen metallia joka hapettuu liuokseen pitäen ionikonsentraatiota yllä. Huom! Toinen käytännön sovellus aktiivisiin elektrodeihin on että puhdistettava metalli kytketään positiiviseen napaan ja puhdas metalli negatiiviseen. Epäpuhdas metalli hapettuu ja epäpuhtaudet pääsevät valumaan elektrolyysiliuoksen pohjalle (elektrolyysisakka), negatiivisella navalla ionit pelkistyvät puhtaan metallin pintaan.
Esimerkkinä tästä sitten kirjan työ 6: https://vimeo.com/245349493/dac648cf73
Tulosten käsittely ja havainnot voisi tietysti koettaa tehdä itsekin mutta lienee monille hyvin vaikeaa ja työlästä niin laitan alle valmiiksi, paljonhan niitä tulee. Katso video ja läpi käy tulokset ja havainnot (laskuosiot käydään ensi kerralla).
elektrolyysi_havainnot.pdf
Harjoituksia: 2.30 (palautettava) ja 2.33
Syventävänä tehtävänä niille joilla osaaminen riittää hyvä tehtävä olisi 2.35
opetus.tv:n videoita: https://opetus.tv/kemia/ke4/elektrolyysi/
Tehtävän 2.24 palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
16.4.2020 - Sähköpari
2.17 A palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
15.5.2020 - Normaalipotentiaali
Jalomman metallin hapettunut muoto (ionit) pelkistyy spontaanisti ollessaan yhteydessä epäjalomman metallin kanssa joka hapettuu.
https://vimeo.com/245173866/1a98121ef4
Jos elektronien siirto tapahtuu ulkoista johdinta pitkin saadaan sähköpari, jota voidaan hyödyntää sähköenergian tuotannossa.
Esim. Galvaaninen kenno
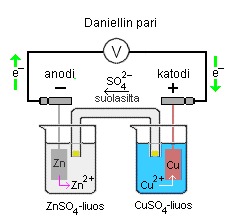
Daniellin pariksi sanotaan sinkin ja kuparin muodostamaa galvaanista kennoa, sama informaatio kuin yllä olevassa kuvassa voidaan esittää myös kennokaavion avulla (alla).
Zn(s) | ZnSO4(aq) || CuSO4(aq) | Cu(s)
Anodireaktio on hapettuminen ja se tapahtuu kennon negatiivisella navalla:
Anodi: Zn(s) → Zn2+(aq) + 2e-
Katodireaktio on pelkistyminen ja se tapahtuu kennon positiivisella navalla:
Katodi: Cu2+(aq) + 2e- → Cu(s)
Kennoreaktio on kokonaisreaktio joka saadaan laskemalla osareaktiot yhteen sen jälkeen kun ne on lavennuttu sellaisella luvulla että siirtyvien elektronien määrät ovat yhtä suuret.
Kenno: Zn(s) + Cu2+(aq)→ Zn2+(aq) + Cu(s)
https://vimeo.com/245175963/9965d5e527
Normaalipotentiaalin määrittäminen
Normaalivetyelektrodi: Vetykaasua kuplitetaan platinalevyn pintaan. Mitataan aineen ja vedyn välinen jännite galvaanisessa kennossa (c=1M, T= 298,15K, p=101,325 kPa).
Esim. Sinkin normaalipotentiaalin määrittäminen

Anodi: Zn(s) → Zn2+(aq) + 2e-
Katodi: 2 H+(aq) + 2e- → H2 (g)
Kenno: Zn(s) + 2 H+(aq) → Zn2+(aq) + H2 (g)
Jännite: 0,76V
Esim. Kuparin normaalipotentiaalia määritettäessä elektronit liikkuvat toiseen suuuntaan (vedyltä kuparille).
Anodi: H2 (g) → 2 H+(aq) + 2e-
Katodi: Cu2+(aq) + 2e- → Cu(s)
Kenno: H2 (g) + Cu2+(aq) → 2 H+(aq) + Cu(s)
Jännite: 0,34V
Sovitaan vedyn pelkistymispotentiaaliksi 0V ja herkemmin pelkistyvien potentiaali positiiviseksi.
Ep(Cu) = +0,34 V
Ep(Zn) = -0,76 V
Hapettumispotentiaali on tällöin pelkistymispotentiaalin vastaluku.
Näin voidaan ennustaa esim. Daniellin kennon
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
jännite
Sinkki hapettuu Eh = +0,76 V
Kupari pelkistyy Ep = +0,34 V
Ekenno = 1,10 V
Sähköparin elektrodien välinen jännite riippuu
- elektrodeilla reagoivien aineiden kyvystä sitoa elektroneja
- lämpötilasta
- kennossa olevien aineiden pitoisuuksista
- kennon kuormituksesta
(ei virtaa → suurin jännite eli lähdejännite)
(virta → hyötysuhde alle 100% eli napajännite aina lähdejännitettä pienempi)
2.15 Rautalevy upotetaan liuoksiin: Ag+(aq), Cu2+(aq) ja Mg2+(aq). Perustele normaalipotentiaalien avulla, missä liuoksissa rautalevyn pinnalle muodostuu metallikerros.
Ratkaisu:
Rautalevyn pinnalle muodostuu metallikerros liuoksissa, joissa on Ag+- tai Cu2+-ioneja.
Rauta on näitä metalleja epäjalompi (normaalipotentiaalitaulukossa ylempänä, löytyy taukkokirjasta), jolloin rauta-atomit hapettuvat ja hopea- tai kupari-ionit pelkistyvät alkuaine metalliksi.
Hopea-ioneja sisältävässä liuoksessa Eh + Ep = +0,45 V + 0,80 V = +1,25 V.
Kupari(II)-ioneja sisältävässä liuoksessa Eh + Ep = +0,45 V + 0,34 V = +0,79 V.
Opetus.tv :ssä hyvin videoita
https://opetus.tv/kemia/ke4/normaalipotentiaali/
Harjoituksia 2.13, 2.16, 2.17 (palauta A kohta, otetaan B esimerkkinä...)
tehtävän 2.9 palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
9.4.2020 - Hapetusluvut
Hapetuslukujen määräämiseen on muutama yksinkertainen sääntö

Käytännössä kannattaa lähteä liikkeelle hapesta tai vedystä. Jos yhdisteessä ei ole näitä niin alkali- tai maa-alkalimetalleista. Tämän jälkeen joutuu kikkailemaan taulukon kanssa hieman enemmän.
Esim.

Hapetuslukuja voidaan käyttää esimerkiksi tasapainottamaan reaktioyhtälöitä jotka muutoin olisivat vaikeita. Ensin tasapainotetaan niiden atomien/yhdisteiden kertoimet joilla hapetusluvut muuttuvat siten, että luovutettujen ja vastaanotettujen elektronien lukumäärät ovat yhtä suuret. Seuraavaksi tasapainotetaan muiden yhdisteiden kertoimet niin että atomien lukumäärät yhtälön molemmin puolin täsmäävät. Lopuksi voi halutessaan tarkistaa hapetuslukujen avulla.
Esim.

Kannattaa huomata että saman alkuaineen eri atomit voivat reagoida niin että hapetuslukujen muutokset ovat erisuuria.
Esim.

Hapetus-pelkistysreaktioita voidaan tasapainottaa myös jakamalle se hapetusreaktioon ja pelkistysreaktioon ja tämän jälkeen tasapainottamalla puolireaktiot erikseen ja huomioimalla siirtyvien elektronien määrä. (Osareaktioita voi kaivella taulukosta.)

opetus.tv:n videoita aiheeseen
https://www.youtube.com/watch?time_continue=16&v=8oScxW1RRVg&feature=emb_logo
https://www.youtube.com/watch?time_continue=260&v=pV1_ZibVfgw&feature=emb_logo
Harjoituksia
s.51 2.2, 2.6, 2.9 (palautettava)
8.4.2020 - Oksidien happo-emäsluonne
Epämetallioksidien vesiliuokset happamia, metallioksidien vesiliuokset emäksisiä.
Esimerkiksi sadeveden happamoituminen johtuu enimmäkseen rikin ja typen oksideista.
2 SO2 (g) + O2 (g) → 2 SO3 (g)
SO3 (g) + H2O (l) → H2SO4 (aq)
H2SO4 (aq) + H2O (l) → HSO4+ (aq) + H3O+ (aq)
Veden pH laskee kun sinne muodostuu oksoniumioneita.
2 NO(g) + O2(g) → 2 NO2(g)
3 NO2(g) + H2O(l) → 2 HNO3(aq) + NO(g)
HNO3 (aq) + H2O (l)→ NO3− + H3O+ (aq)
Virvoitusjuomien hiilihappo tulee siihen liuenneesta hiilidioksidista.
CO2 (g) + H2O (l) ↔ H2CO3 (aq)
H2CO3 (aq) + H2O (l) ↔ HCO3- (aq) + H3O+ (aq)
Fosforioksideista tulee fosforihappoa ja jne.
Karbonaateista vapautuu kuumennettaessa tai happojen vaikutuksesta hiilidioksia ja usein myös metallioksidia (joka voi reagoida edelleen hapon kanssa). Esimerkiksi kalkkikiveä kuumentamalla saadaan poltettua kalkkia.
CaCO3 (s) → CaO (s) + CO2 (g)
Joka reagoi vaarallisen voimakkaasti veden kanssa muodostaen sammutettua kalkkia.
CaO (s) + H2O (l) → Ca(OH)2 (aq)
Ca(OH)2 (aq) → Ca2+ (aq) + 2 OH- (aq)
Veden pH nousee kun sinne muodostuu hydroksidi-ioneita.
Ohessa vielä videoita aiheeseen.
https://www.youtube.com/watch?v=SJUX6sJMCG0
https://www.youtube.com/watch?v=qaBUHS5dJhQ
https://www.youtube.com/watch?v=dmgLESI4GGU
Harjoituksena tutustu amfoteeriseen oksidiin
s.38 1.20
+ Palautettavana tehtävänä pieni testi johon linkki löytyy wilmasta.
Tehtävän 1.5 palautus
Sinulla ei ole tarvittavia oikeuksia lähettää mitään.
6.4.2020 - Jaksollinen järjestelmä
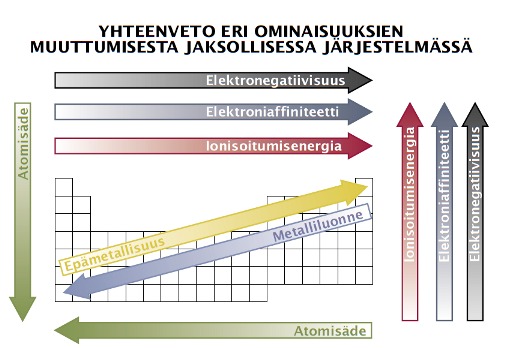
Jaksollisen järjestelmän ominaisuuksia
Elektronegatiivisuus on suhteellinen mitta, joka kuvaa sitä, miten voimakkaasti atomi vetää puoleensa yhteisiä sidoselektroneja molekyylissä. Esimerkiksi happiatomin elektronegatiivisuus on suurempi kuin vetyatomin, joten vesimolekyylissä suurempi osuus happi-vetysidosten elektronitiheydestä on happea lähellä.
Ionisoitumisenergia eli ionisaatioenergia (tunnus I tai Ei) on energia, joka vähintään tarvitaan elektronin irrottamiseksi kaasumaisesta atomista tai molekyylistä. Ilmoitetaan usein yksikössä kJ/mol Esim. Na(g) -> Na+(g) + e- ∆E = +494 kJ/mol. Ionisoitumisenergian avulla voidaan arvioida, kuinka helposti atomi luovuttaa elektronitiheyttään.
Elektroniaffiniteetti tarkoittaa energiamäärää (kJ/mol) joka sitoutuu tai vapautuu kun kaasufaasissa olevaan atomiin tai ioniin liittyy yksi elektroni. Esim. F(g) + e- F-(g) ∆E = - 328 kJ/mol.
Atomien kokoon vaikuttaa millä kuorella uloimmat elektronit ovat joten suuremmat atomit löytyvät alempaa jaksollisesta järjestelmästä. Toinen vaikuttava asia on positiivisen varauksen suuruus ytimessä joka vetää elektroneja puoleensa. Näin pienemmät atomit löytyvät oikeasta laidasta. Eli atomisäde kasvaa ryhmissä ja pienenee jaksoissa.
Metallit pyrkivät reagoimaan luovuttamalla elektroneja ja ne irtovat sitä helmpommin mitä kauempana ne ovat ytimestä. Epämetalleilla päinvastoin. Eli metallien reaktiokyky suurempi isommilla atomeilla, epämetallien pienillä.
Metallien ionit atomeja pienempiä, epämetalleilla suurempia koska metallien ioneilla vähemmän elektronikuoria ja epämetallien ioneilla ylimääräisiä elekroneja jotka hylkivät toisiaan.
Esimerkkeinä
Harjoituksia
s.23 1.4
s.26 1.5 (palautettava)
s.33 1.10, 1.12, 1.13, 1.15, 1.16