20.4.2020 - Elektrolyysin teoria
Luultavasti kurssin haastavin asia sitten tällä viikkoa. Pilkotaan tätä vähän useampaan osaan.
Galvaanisessa kennossa spontaani hapetus-pelkistysreaktio saa aikaan sähkövirran. Elektrolyysissä sähkövirta aiheuttaa hapetus-pelkistysreaktion. Kannattaa jo heti alkuun kiinnittää huomio että elektrolyysi suoritetaan tässä yhdessä kennossa kun galvaanisessa kennossa kennoja oli kaksi.
Elektrolyyseistä pitäisi hallita kolme eri tapausta:
1) Suolan sulatteen elektrolyysi passiivisilla elektrodeilla.
2) Suolan vesiliuoksen elektrolyysi passiivisilla elektrodeilla.
3) Esineen päällystäminen metallilla tai metallin puhdistaminen käyttämällä aktiivisia elektrodeja.
Passiivinen elektrodi tarkoittaa sähkönjohdinta kennossa joka ei osallistu reaktioon (tyypillisesti hiili tai platina). Aktiivinen elektrodi voi olla vaikkapa kultasauva päällystettäessä koruja ohuella jalometallikerroksella tai sinkki jos halutaan päällystää rautaesine korroosiolta suojaavalta kerrokselta.
Tapauksessa 1) kationit (positiiviset ionit) pelkistyvät jännitelähteen negatiiviseen napaan kiinnitetyllä elektrodilla (katodi) ja anionit (negatiiviset ionit) hapettuvat positiiviseen napaan (anodi) kiinnitetyllä elektrodilla. Kannattaa huomata että tämä vaatii paljon energiaa ja korkeita lämpötiloja että suola voidaan sulattaa.

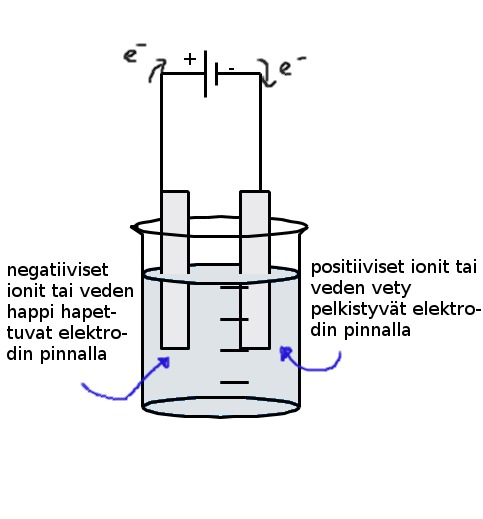
Tapauksessa 2) on huomioitava että elektrodilla voi reagoida vesi tai suola. Se mitä ainetta anodilla ja katodilla muodostuu riippuu reagoivien aineiden normaalipotentiaaleista. Korkeamman potentiaalin omaava reaktio tapahtuu. Huom! Tapauksissa jossa normaalipotentiaalit ovat lähellä toisiaan (kloridi-ionit ja vesi) tapahtuu molemmat reaktiot ja suolan konsentraatio vaikuttaa siihen kuinka paljon kumpaakin ainetta syntyy.
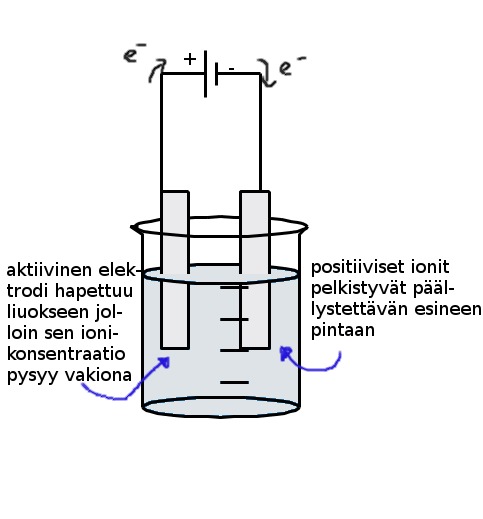
Tapauksessa 3) päällystettävä esine kiinnitettään jännitelähteen negatiiviseen napaan ja liuokseen laitetaan päällystävän aineen ioneita. Positiiviseen napaan kytketään päällystävän aineen metallia joka hapettuu liuokseen pitäen ionikonsentraatiota yllä. Huom! Toinen käytännön sovellus aktiivisiin elektrodeihin on että puhdistettava metalli kytketään positiiviseen napaan ja puhdas metalli negatiiviseen. Epäpuhdas metalli hapettuu ja epäpuhtaudet pääsevät valumaan elektrolyysiliuoksen pohjalle (elektrolyysisakka), negatiivisella navalla ionit pelkistyvät puhtaan metallin pintaan.
Esimerkkinä tästä sitten kirjan työ 6: https://vimeo.com/245349493/dac648cf73
Tulosten käsittely ja havainnot voisi tietysti koettaa tehdä itsekin mutta lienee monille hyvin vaikeaa ja työlästä niin laitan alle valmiiksi, paljonhan niitä tulee. Katso video ja läpi käy tulokset ja havainnot (laskuosiot käydään ensi kerralla).
elektrolyysi_havainnot.pdf
Galvaanisessa kennossa spontaani hapetus-pelkistysreaktio saa aikaan sähkövirran. Elektrolyysissä sähkövirta aiheuttaa hapetus-pelkistysreaktion. Kannattaa jo heti alkuun kiinnittää huomio että elektrolyysi suoritetaan tässä yhdessä kennossa kun galvaanisessa kennossa kennoja oli kaksi.
Elektrolyyseistä pitäisi hallita kolme eri tapausta:
1) Suolan sulatteen elektrolyysi passiivisilla elektrodeilla.
2) Suolan vesiliuoksen elektrolyysi passiivisilla elektrodeilla.
3) Esineen päällystäminen metallilla tai metallin puhdistaminen käyttämällä aktiivisia elektrodeja.
Passiivinen elektrodi tarkoittaa sähkönjohdinta kennossa joka ei osallistu reaktioon (tyypillisesti hiili tai platina). Aktiivinen elektrodi voi olla vaikkapa kultasauva päällystettäessä koruja ohuella jalometallikerroksella tai sinkki jos halutaan päällystää rautaesine korroosiolta suojaavalta kerrokselta.
Tapauksessa 1) kationit (positiiviset ionit) pelkistyvät jännitelähteen negatiiviseen napaan kiinnitetyllä elektrodilla (katodi) ja anionit (negatiiviset ionit) hapettuvat positiiviseen napaan (anodi) kiinnitetyllä elektrodilla. Kannattaa huomata että tämä vaatii paljon energiaa ja korkeita lämpötiloja että suola voidaan sulattaa.

Tapauksessa 2) on huomioitava että elektrodilla voi reagoida vesi tai suola. Se mitä ainetta anodilla ja katodilla muodostuu riippuu reagoivien aineiden normaalipotentiaaleista. Korkeamman potentiaalin omaava reaktio tapahtuu. Huom! Tapauksissa jossa normaalipotentiaalit ovat lähellä toisiaan (kloridi-ionit ja vesi) tapahtuu molemmat reaktiot ja suolan konsentraatio vaikuttaa siihen kuinka paljon kumpaakin ainetta syntyy.

Tapauksessa 3) päällystettävä esine kiinnitettään jännitelähteen negatiiviseen napaan ja liuokseen laitetaan päällystävän aineen ioneita. Positiiviseen napaan kytketään päällystävän aineen metallia joka hapettuu liuokseen pitäen ionikonsentraatiota yllä. Huom! Toinen käytännön sovellus aktiivisiin elektrodeihin on että puhdistettava metalli kytketään positiiviseen napaan ja puhdas metalli negatiiviseen. Epäpuhdas metalli hapettuu ja epäpuhtaudet pääsevät valumaan elektrolyysiliuoksen pohjalle (elektrolyysisakka), negatiivisella navalla ionit pelkistyvät puhtaan metallin pintaan.

Esimerkkinä tästä sitten kirjan työ 6: https://vimeo.com/245349493/dac648cf73
Tulosten käsittely ja havainnot voisi tietysti koettaa tehdä itsekin mutta lienee monille hyvin vaikeaa ja työlästä niin laitan alle valmiiksi, paljonhan niitä tulee. Katso video ja läpi käy tulokset ja havainnot (laskuosiot käydään ensi kerralla).
elektrolyysi_havainnot.pdf
Harjoituksia: 2.30 (palautettava) ja 2.33
Syventävänä tehtävänä niille joilla osaaminen riittää hyvä tehtävä olisi 2.35
opetus.tv:n videoita: https://opetus.tv/kemia/ke4/elektrolyysi/