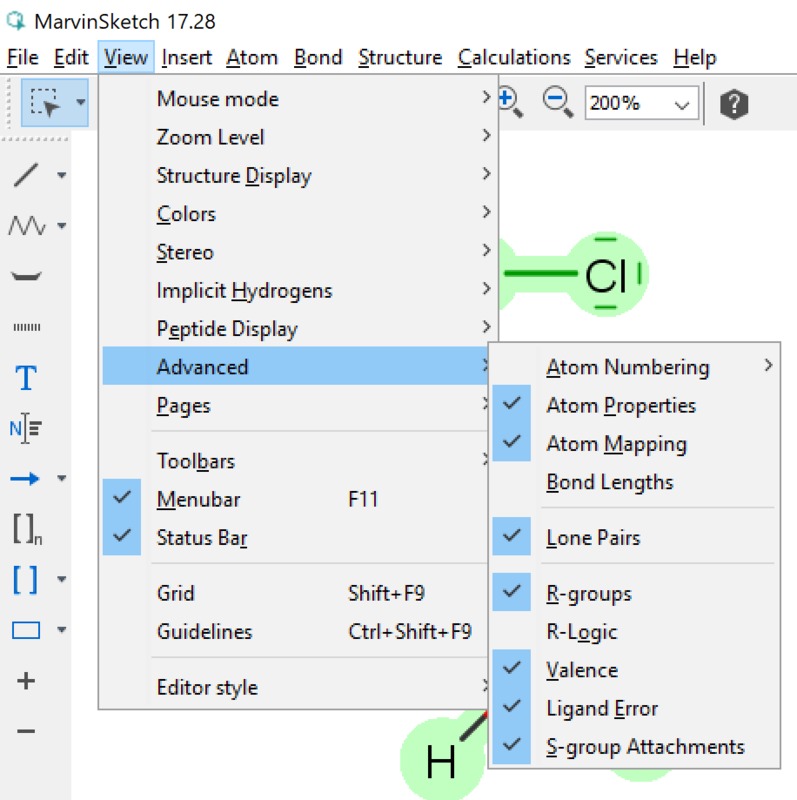
Vapaiden elektroniparien piirtäminen§
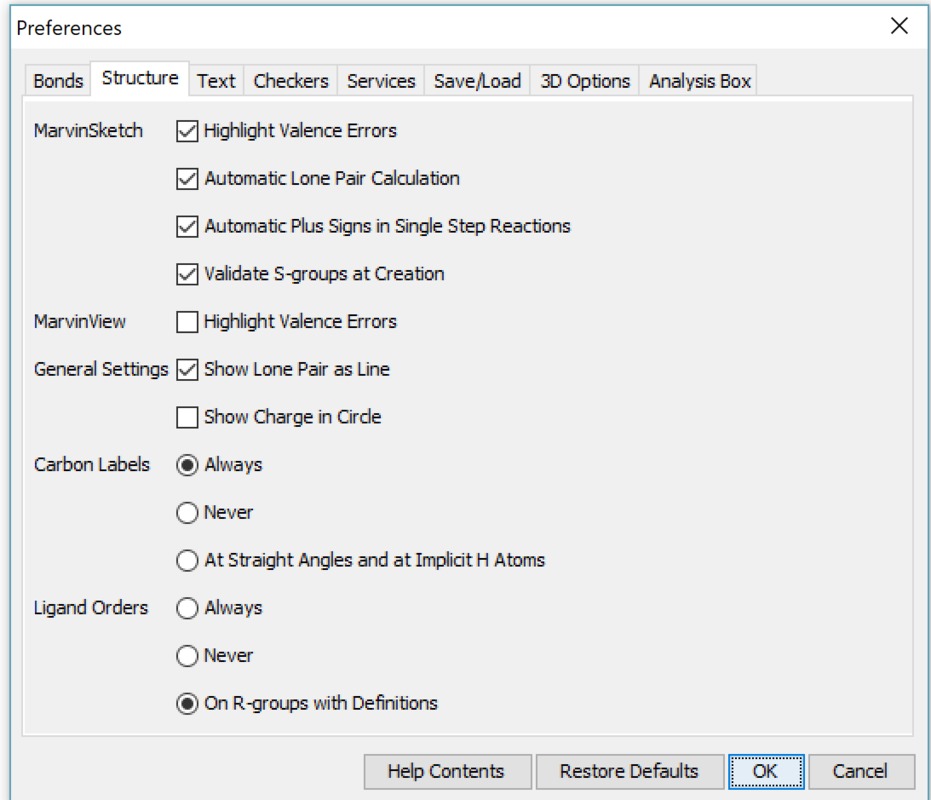
 Yleiset asetukset (General settings) -kohdassa asetus, jossa määritellään vapaiden elektroniparien näkyminen molekyylissä. Vapaiden elektroniparien tunnistaminen on tärkeää aineen kemiallisten ominaisuuksien kannalta. Tässä ruudussa tehdään valinta sen suhteen, näytetään vapaa elektronipari pisteinä tai viivana (kts. kuvan ammoniakki-molekyylit). Jotta vapaat elektroniparit tulevat yleensä näkyviin on View-valikosta valittava tätä koskeva kohta (kuva vieressä). View | Advanced | Lone Pair -valinta saa vapaat elektroniparit näkyville. Orgaanisten molekyylien rakenteeseen voidaan piirtää myös vapaat elektroniparit (Lone Pair). Näiden merkityksestä oma tarinansa oppikirjoissa (mm. amiinien emäksisyys perustuu tähän). Vapaiden elektroniparien saaminen näkyviin tapahtuu kahdella tapaa: pisteillä tai viivalla (kts. ao. kuva).
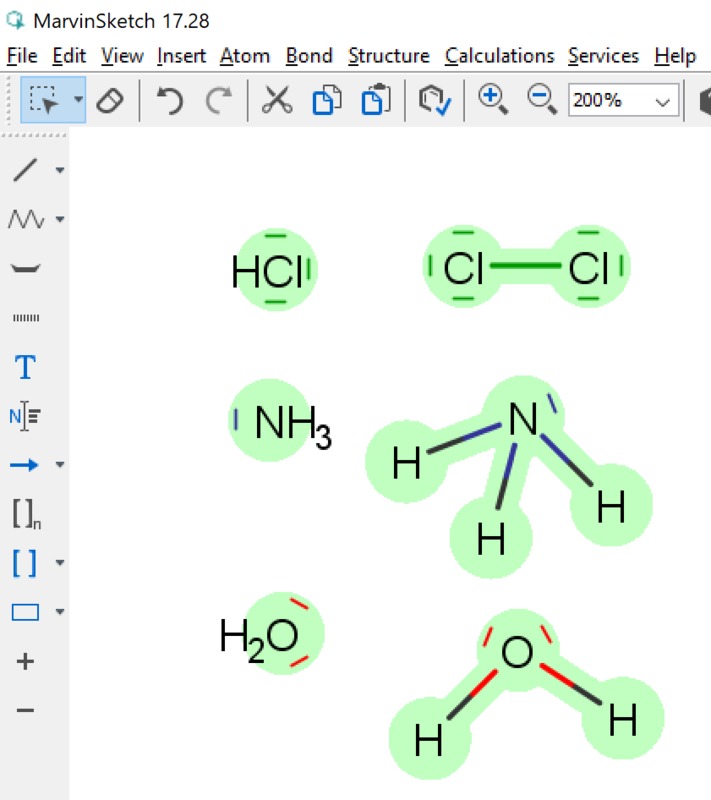
Yleiset asetukset (General settings) -kohdassa asetus, jossa määritellään vapaiden elektroniparien näkyminen molekyylissä. Vapaiden elektroniparien tunnistaminen on tärkeää aineen kemiallisten ominaisuuksien kannalta. Tässä ruudussa tehdään valinta sen suhteen, näytetään vapaa elektronipari pisteinä tai viivana (kts. kuvan ammoniakki-molekyylit). Jotta vapaat elektroniparit tulevat yleensä näkyviin on View-valikosta valittava tätä koskeva kohta (kuva vieressä). View | Advanced | Lone Pair -valinta saa vapaat elektroniparit näkyville. Orgaanisten molekyylien rakenteeseen voidaan piirtää myös vapaat elektroniparit (Lone Pair). Näiden merkityksestä oma tarinansa oppikirjoissa (mm. amiinien emäksisyys perustuu tähän). Vapaiden elektroniparien saaminen näkyviin tapahtuu kahdella tapaa: pisteillä tai viivalla (kts. ao. kuva).| Valitaan vapaat eletkroniparit näkyviin (View | Advanced | Lone Pairs) ja yleisissä asetuksissa on valittu esitysmuodoksi viiva. | Tässä kuvassa em. valinta poistettu. |
 |
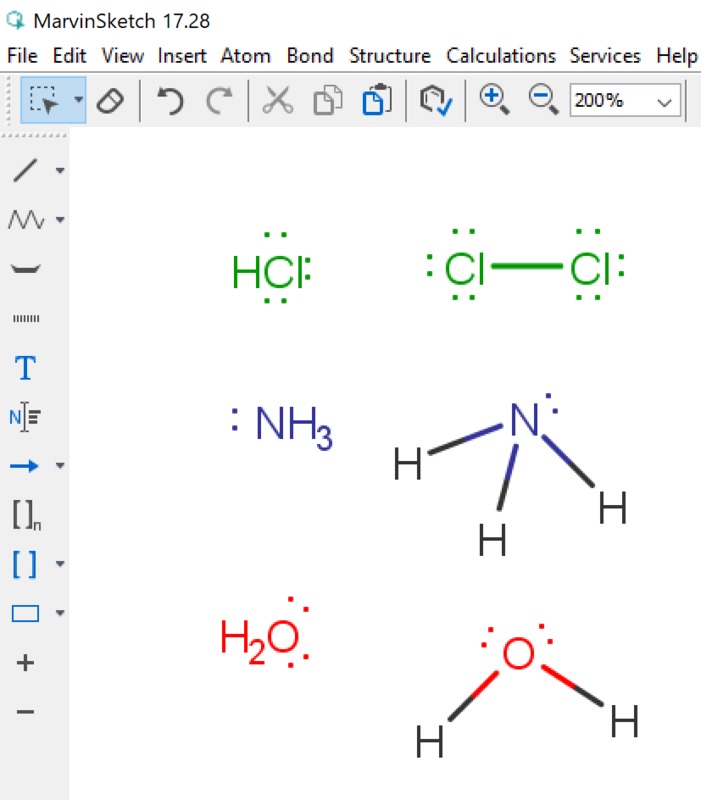 |
Alla kuvakaappaukset näistä. Seuraavissa kuvissa valinnat ohjelmassa.
Opettajalle: Lewisin happo-emäs-teoriassa emäs määritellään siten, että se luovuttaa vapaan elektroniparin yhteiseen kovalenttiseen (koordinaatio) sidokseen. Vastaavasti happo vastaanotta em. vapaan elektroniparin. Perinteisesti yläkoulussa ja lukiossakin hapot ja emäkset määritellään Brönstedtin määritelmän mukaan (happo luovuttaa protonin, vety-ionin, ja vastaavasti emäs vastaanottaa sen). Metallikompleksien yhteydessä em. Lewisin määritelmä on konkreettisesti esitettävissä (ei kuitenkaan mainita lukion opetussuunnitelmassa).