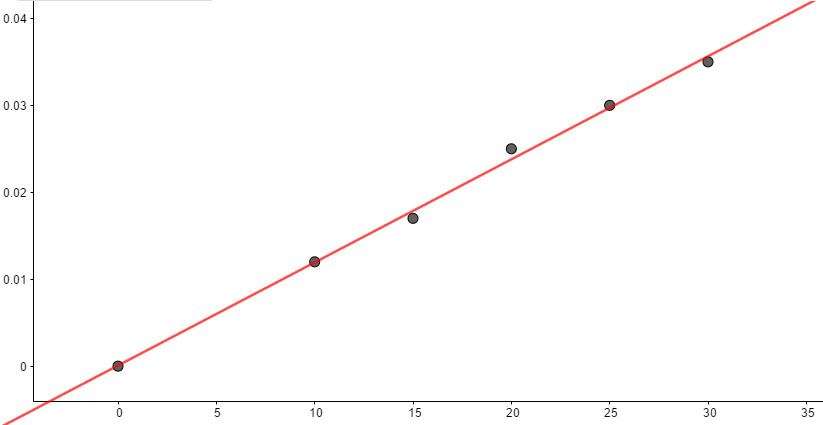
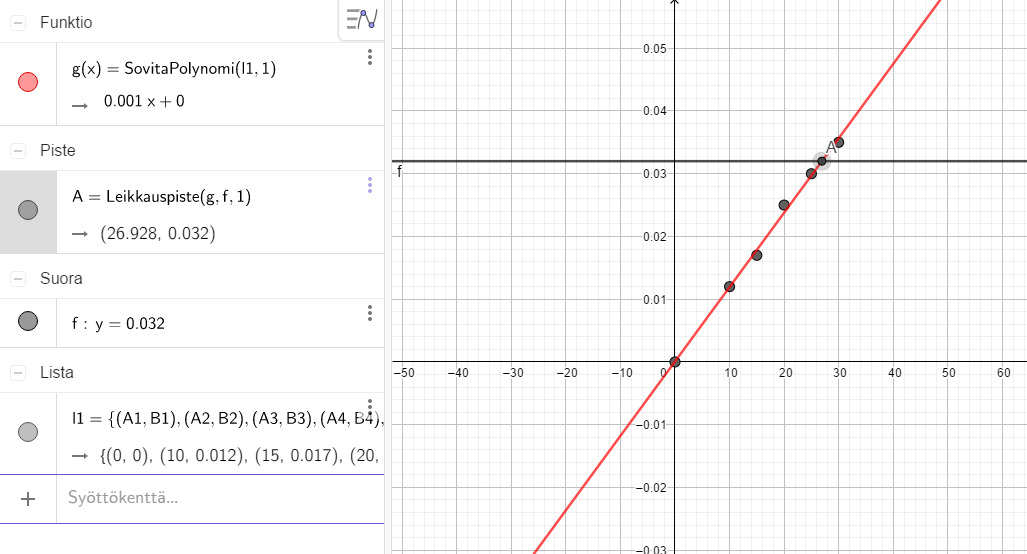
Tehtävät
Kpl 5.1
5.1
a) Polymeerin pienin rakenneyksikkö
b) Jako perustuu reaktiotyyppiin, jolla polymeeriä valmistetaan tai joka syntyy elävässä solussa
c) Molekyyli, jolla on joko suhteellisen suuri molekyylimassa tai sellainen rakenne, joka sisältää paljon toistuvia rakenneyksiköitä, joilla on suhteellisen pieni molekyylimassa
d) Synteettisiä: muovit, synteettiset kumit ja tekokuidut - luonnon polymeerejä: hiilihydraatit, proteiinit ja nukleiinihapot
e) Eloperäisiä eli orgaanisia polymeereja. Tärkkelys, selluloosa, proteiinit, peptidit, DNA ja RNA ovat kaikki esimerkkejä biopolymeereista, jotka koostuvat monomeereista eli sokerista, aminohapoista ja nukleotideista.
5.2
Polyvinyylikloridi (PVC): Sadevaatteet
Polystyreeni (PS): Eristemateriaali
Kollageeni: Sidekudos
Polyeteenitereftalaatti (PET): Virvoitusjuomapullo
Polytetrafluorieteeni (teflon): Paistinpannu
Polyeteeni (PE): Leipäpussi
Tärkkelys: Peruna
Deoksiribonukleiinihappo(DNA): Tuma
Polyamidi: Ulkoiluvaate
Albumiini: Veri
Biopolymeerejä ovat kollageeni, tärkkelys, deoksiribonukleiinihappo ja alubumiini
5.3
a)
1= Eteeni, alkeeni/tyydyttymätön hiilivety
2= Kloorieteeni; halogeenialkeeni
3= Fenyylieteeni (Vinyylibentseeni); aromaattinen, tyydymätön yhdiste
4= 1,1,2,2-Tetrafluorieteeni; halogeenialkeeni
5= 1,6-heksaanidihappo, kaksiarvoinen karboksyylihappo
6= 1,6-diaminoheksaani; kaksiarvoinen (Primäärinen) amiini
5.4
Kpl 4.3
Kpl 4.2
Kpl 4.1
4.2
Na:
- Reagoi kiivasti veden kanssa
- Esiintyy merivedessä
- Pelkistetään sähkökemiallisesti
- Hyvin kevyttä
- Säätelee soulunesteiden ionitasapainoa
- Palaa keltaisella liekillä
- Hilarakenteessa kationeja ja elektroneja
Cu:
- Hilarakenteessa kationeja ja elektroneja
- Voidaan pelkistää kemiallisesti
- Käytetään sähköjohteena
- Jalometalli
- Eletroneja d-orbiaaleilla
- On elimistön hivenaine
- On messingin aineosa
- Reagoi ilman kaasujen kanssa muodostaen patinaa
- On siirtymämetalli
- Tiheys suurempi kuin vedellä
4.3
Malmin louhiminen
Malmin rikastus
Pasutus
Pelkistys raakametalliksi
Raakametallin puhdistus
Tuotteen valmistus
4.5

%3D1%5C%20kg%3D100%5C%20g)
%3D14%7B%2C%7D05%5C%20g)
%3D38%7B%2C%7D4%5C%20g)
%3D8%7B%2C%7D65%5C%20g)
%3D4%7B%2C%7D32%5C%20g)
%3D34%7B%2C%7D6%5C%20g)
%3D39%7B%2C%7D10%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D35%7B%2C%7D45%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D24%7B%2C%7D31%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D1%7B%2C%7D008%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D16%7B%2C%7D00%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D0%7B%2C%7D35933...%5Capprox0%7B%2C%7D3593%5C%20mol)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D1%7B%2C%7D08321...%5Capprox1%7B%2C%7D0832%5C%20mol)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D0%7B%2C%7D35582...%5Capprox0%7B%2C%7D3558%5C%20mol)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D4%7B%2C%7D28571...%5Capprox4%7B%2C%7D2857%5C%20mol)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D2%7B%2C%7D1625%5C%20mol)
%3An(Cl)%3An(Mg)%3An(H)%3An(O)%3D1%7B%2C%7D01%3A3%7B%2C%7D04%3A1%7B%2C%7D00%3A12%7B%2C%7D0%3A6%7B%2C%7D08)


4.6
4.8
4.9
4.11
Na:
- Reagoi kiivasti veden kanssa
- Esiintyy merivedessä
- Pelkistetään sähkökemiallisesti
- Hyvin kevyttä
- Säätelee soulunesteiden ionitasapainoa
- Palaa keltaisella liekillä
- Hilarakenteessa kationeja ja elektroneja
Cu:
- Hilarakenteessa kationeja ja elektroneja
- Voidaan pelkistää kemiallisesti
- Käytetään sähköjohteena
- Jalometalli
- Eletroneja d-orbiaaleilla
- On elimistön hivenaine
- On messingin aineosa
- Reagoi ilman kaasujen kanssa muodostaen patinaa
- On siirtymämetalli
- Tiheys suurempi kuin vedellä
4.3
Malmin louhiminen
Malmin rikastus
Pasutus
Pelkistys raakametalliksi
Raakametallin puhdistus
Tuotteen valmistus
4.5
Oletetaan että on kilo karnaliittia
Muodostetaan ainemäärien suhde jakamalla kaikki ainemäärät pienimmällä (magnesiumin) ainemäärällä:
4.6
4.8
4.9
4.11
Kpl 3.2
3.8
%3D3%7B%2C%7D012g)
%3D2%7B%2C%7D466g)
%3D107%7B%2C%7D87%5Cfrac%7Bg%7D%7Bmol%7D%2B35%7B%2C%7D45%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%3D143%7B%2C%7D32%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D107%7B%2C%7D87%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%2B14%7B%2C%7D01%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%2B3%5Ccdot16%7B%2C%7D00%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%3D169%7B%2C%7D88%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%5Cleft(AgCl%5Cright)%7D%7BM%5Cleft(AgCl%5Cright)%7D%3D%5Cfrac%7B2%7B%2C%7D466%5C%20g%7D%7B143%7B%2C%7D32%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D0%7B%2C%7D01720625...%5Capprox0%7B%2C%7D0172063%5C%20mol)
%2BCl%5E-%5Cleft(aq%5Cright)%5Crightarrow%20AgCl%5Cleft(s%5Cright))
%3Dn%5Cleft(AgCl%5Cright))
%3Dn%5Cleft(AgCl%5Cright))
%3DnM%3D0%7B%2C%7D0172063%5C%20mol%5Ccdot169%7B%2C%7D88%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%3D2%7B%2C%7D923006...%5Capprox2%7B%2C%7D92301g)
%3D%5Cfrac%7B2%7B%2C%7D92301%5C%20g%7D%7B3%7B%2C%7D012%5C%20g%7D%3D0%7B%2C%7D97045...%5Capprox0%7B%2C%7D9705%3D97%7B%2C%7D05%5C%25)
%3D100%5C%25-97%7B%2C%7D05%5C%25%3D2%7B%2C%7D95%5C%25)
3.10
 b)
b)
%3D3%7B%2C%7D00g)
%3D315cm%5E3%3D315%5Ccdot10%5E%7B-6%7Dm%5E3)


K%3D294%7B%2C%7D15K)
%3D105%7B%2C%7D99%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

%3D%5Cfrac%7B96%7B%2C%7D5%5Ccdot10%5E3%5C%20Pa%5Ccdot315%5Ccdot10%5E%7B-6%7Dm%5E3%7D%7B8%7B%2C%7D31451%5C%20%5Cfrac%7BPa%5Ccdot%20m%5E3%7D%7Bmol%5Ccdot%20K%7D%5Ccdot294%7B%2C%7D15K%7D%3D0%7B%2C%7D01242889...%5Capprox0%7B%2C%7D0124289%5C%20mol)
%3Dn%5Cleft(CO_2%5Cright)%3D0%7B%2C%7D0124289%5C%20mol)
%3DnM%3D0%7B%2C%7D0124289%5C%20mol%5Ccdot105%7B%2C%7D99%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%3D1%7B%2C%7D31733...%5Capprox1%7B%2C%7D3173%5C%20g)
%3D%5Cfrac%7B1%7B%2C%7D3173%5C%20g%7D%7B3%7B%2C%7D00%5C%20g%7D%3D0%7B%2C%7D4391%3D43%7B%2C%7D91%5C%25)
3.11

%3Dc%5Ccdot%20V%3D0%7B%2C%7D0104%5C%20%5Cfrac%7Bmol%7D%7Bl%7D%5Ccdot0%7B%2C%7D0315%5C%20l%3D3%7B%2C%7D276%5Ccdot10%5E%7B-4%7Dmol%3Dn%5Cleft(Mg%5E%7B2%2B%7D%5Cright)%2Bn%5Cleft(Ca%5E%7B2%2B%7D%5Cright))
)
%3Dc%5Ccdot%20V%3D0%7B%2C%7D0104%5C%20%5Cfrac%7Bmol%7D%7Bl%7D%5Ccdot0%7B%2C%7D0187%5C%20l%3D1%7B%2C%7D9448%5Ccdot10%5E%7B-4%7D%5C%20mol%3Dn%5Cleft(Mg%5E%7B2%2B%7D%5Cright))
%3D%5Cfrac%7B1%7B%2C%7D9448%5Ccdot10%5E%7B-4%7D%5C%20mol%7D%7B0%7B%2C%7D010%5C%20l%7D%3D1%7B%2C%7D9448%5Ccdot10%5E%7B-3%7D%5C%20mol%5Capprox1%7B%2C%7D94%5Ccdot10%5E%7B-3%7D%5C%20mol)
%3D%5Cfrac%7B1%7B%2C%7D3312%5Ccdot10%5E%7B-4%7D%5C%20mol%7D%7B0%7B%2C%7D010%5C%20l%7D%3D1%7B%2C%7D3312%5Ccdot10%5E%7B-3%7D%5C%20%5Cfrac%7Bmol%7D%7Bl%7D%5Capprox1%7B%2C%7D33%5Ccdot10%5E%7B-3%7D%5C%20%5Cfrac%7Bmol%7D%7Bl%7D)
3.12
%2B3H_2SO_4%5Cleft(aq%5Cright)%5Crightarrow%20Al_2%5Cleft(SO_4%5Cright)_3%5Cleft(aq%5Cright)%2B3H_2%5Cleft(g%5Cright))
%2BH_2SO_4%5Cleft(aq%5Cright)%5Crightarrow%20ZnSO_4%5Cleft(aq%5Cright)%2BH_2%5Cleft(g%5Cright))
%3D1%7B%2C%7D00g)
%3D84%7B%2C%7D0%5C%20mg%3D84%7B%2C%7D0%5Ccdot10%5E%7B-3%7Dg)
%3D2%7B%2C%7D016%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B84%7B%2C%7D0%5Ccdot10%5E%7B-3%7D%5C%20g%7D%7B2%7B%2C%7D016%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D0%7B%2C%7D0416666..%5Capprox0%7B%2C%7D041667%5C%20mol)
%3Dn%5Cleft(H_2%5Cright)%3D0%7B%2C%7D04167%5C%20mol)
%7D%7Bn%5Cleft(Al%5Cright)%7D%3D%5Cfrac%7B3%7D%7B2%7D) , joten
, joten %3D%5Cfrac%7B3%7D%7B2%7Dn%5Cleft(Al%5Cright))
%3Dn%5Cleft(Zn%5Cright)%2B%5Cfrac%7B3%7D%7B2%7Dn%5Cleft(Al%5Cright))
g%7D%7B65%7B%2C%7D38%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D0%7B%2C%7D654437%5C%20g%5Capprox0%7B%2C%7D654%5C%20g) 3.13
3.13
_3%2BMg%5Cleft(OH%5Cright)_2)
_3%5Cleft(aq%5Cright)%2B3HCl%5Cleft(aq%5Cright)%5Crightarrow%20AlCl_3%5Cleft(aq%5Cright)%2B3H_2O%5Cleft(l%5Cright))
_2%5Cleft(aq%5Cright)%2B2HCl%5Cleft(aq%5Cright)%5Crightarrow%20MgCl_2%5Cleft(aq%5Cright)%2B2H_2O%5Cleft(l%5Cright))
%3D37%7B%2C%7D7%5C%20ml%3D37%7B%2C%7D7%5Ccdot10%5E%7B-3%7Dl%3D37%7B%2C%7D7%5Ccdot10%5E%7B-3%7Ddm%5E3)
%3D2%7B%2C%7D50%5C%20%5Cfrac%7Bmol%7D%7Bdm%5E3%7D)
_3%2BMg%5Cleft(OH%5Cright)_2%5Cright)%3D2%7B%2C%7D50g)
_4%5Cright)%3D78%7B%2C%7D004%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
_2%5Cright)%3D58%7B%2C%7D326%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)
%3Dc%5Ccdot%20V%3D2%7B%2C%7D50%5C%20%5Cfrac%7Bmol%7D%7Bdm%5E3%7D%5Ccdot37%7B%2C%7D7%5Ccdot10%5E%7B-3%7Ddm%5E3%3D0%7B%2C%7D09425%5C%20mol)
%7D%7Bn%5Cleft(Al%5Cleft(OH%5Cright)_3%5Cright)%7D%3D%5Cfrac%7B3%7D%7B1%7D) , joten
, joten%3D3%5Ccdot%20n%5Cleft(Al(OH)_3%5Cright))
%7D%7Bn%5Cleft(Mg%5Cleft(OH%5Cright)_2%5Cright)%7D%3D%5Cfrac%7B2%7D%7B1%7D) , joten
, joten %3D2%5Ccdot%20n%5Cleft(Mg%5Cleft(OH%5Cright)_2%5Cright))
%3D3%5Ccdot%20n%5Cleft(Al(OH)_3%5Cright)%2B2%5Ccdot%20n%5Cleft(Mg%5Cleft(OH%5Cright)_2%5Cright))
Saostumisreaktion reaktioyhtälön perusteella
Näin ollen natriumnitraatin massaprosentti on
3.10
a)
a)-kohdan reaktioyhtälön perusteella
3.11
Titraus 1:
Titraus 2:
3.12
Oletetaan, että alumiinin maassa on x ja sinkin 1,00-x
Oletetaan, että Alumiinihydraatin massa on x ja magnesiumhydraatin 2,50-x%2B2%5Ccdot%5Cleft(%5Cfrac%7B%5Cleft(2%7B%2C%7D50-x%5Cright)%5C%20g%7D%7B58%7B%2C%7D326%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%5Cright))
_3%5Cright)%3Dx%5Capprox2.04%5C%20g)
_2%5Cright)%3D2.5-x%5Capprox0%7B%2C%7D455g)
Kpl 3.1
3.1
%2B5O_2%5Cleft(g%5Cright)%5Crightarrow%5Cunderrightarrow%7B4NO%5Cleft(g%5Cright)%7D%2B6H_2O%5Cleft(l%5Cright))
%7D%2B2O_2%5Cleft(g%5Cright)%5Crightarrow4NO_2%5Cleft(g%5Cright))
%2B7O_2%5Cleft(5%5Cright)%5Crightarrow6H_2O%5Cleft(l%5Cright)%2B4NO_2%5Cleft(g%5Cright))
%2B21O_2%5Cleft(g%5Cright)%5Crightarrow18H_2O%5Cleft(l%5Cright)%2B%5Cunderrightarrow%7B12NO_2%5Cleft(g%5Cright)%7D)
%7D%2B4H_2O%5Cleft(l%5Cright)%5Crightarrow8HNO_3%5Cleft(aq%5Cright)%2B4NO%5Cleft(g%5Cright))
%2B21O_2%2B%5Cunderrightarrow%7B4H_2O%5Cleft(l%5Cright)%7D%5Crightarrow%5Cunderrightarrow%7B18H_2O%5Cleft(l%5Cright)%7D_%7B%5Cleft(-4H_2O%5Cright)%7D%2B8HNO_3%5Cleft(aq%5Cright)%2B4NO%5Cleft(g%5Cright))
%2B21O_2%5Crightarrow14H_2O%5Cleft(l%5Cright)%2B8HNO_3%5Cleft(aq%5Cright)%2B4NO%5Cleft(g%5Cright))
%3D%5Cfrac%7B12%7D%7B8%7D%3D1%7B%2C%7D5%5C%20mol)
1 %2B5O_2%5Cleft(g%5Cright)%5Crightarrow4NO%5Cleft(g%5Cright)%2B6H_2O%5Cleft(l%5Cright))
2%2BO_2%5Cleft(g%5Cright)%5Crightarrow2NO_2%5Cleft(g%5Cright))
3%2BH_2O%5Cleft(l%5Cright)%5Crightarrow2HNO_3%5Cleft(aq%5Cright)%2BNO%5Cleft(g%5Cright))
2
3
Kerrotaan reaktio (2) 2:lla
=
Kerrotaan reaktio (1+2) 3:lla ja (3) 4:lla
=
=
3.2
3.3
3.4
3.3
3.4
Kpl 2.4
2.30
a)%2B3e%5E-%5Crightarrow%20Al%5Cleft(s%5Cright))
%5Crightarrow%20I_2%5Cleft(s%5Cright)%2B2e%5E-)
%2B2e%5E-%5Crightarrow%20Ni%5Cleft(s%5Cright))
%5Crightarrow%20Br_2%5Cleft(l%5Cright)%2B2e%5E-)
%2B2e%5E-%5Crightarrow%20Cu%5Cleft(s%5Cright))
Anodireaktio:
%5Crightarrow%20O_2%5Cleft(g%5Cright)%2B4H%5E%2B%5Cleft(aq%5Cright)%2B4e%5E-)
2.31
 Magnesiumbromidi
Magnesiumbromidi
%2B2e%5E-%5Crightarrow%20Mg%5Cleft(s%5Cright))
%5Crightarrow%20Br_2%5Cleft(l%5Cright)%2B2e%5E-)



2.35
%2B2e%5E-%5Crightarrow%20Pb%5Cleft(s%5Cright)%7B%2C%7D%5C%20E_p%3D-0%7B%2C%7D13V%26Na%5E%2B%5Cleft(aq%5Cright)%2Be%5E-%5Crightarrow%20Na%5Cleft(s%5Cright)%7B%2C%7D%5C%20E_p%3D-2%7B%2C%7D01V%26K%5E%2B%5Cleft(aq%5Cright)%2Be%5E-%5Crightarrow%20K%5Cleft(s%5Cright)%7B%2C%7D%5C%20E_p%3D-2%7B%2C%7D93V%5C%5C%0ANO_3%5E-%5C%20ei%5C%20reaktiota%26SO_4%5E%7B2-%7D%7B%2C%7D%5C%20E_h%3D-2%7B%2C%7D01V%262I%5Cleft(s%5Cright)%5Crightarrow%20I_2%2B2e%5E-%7B%2C%7D%5C%20E_h%3D-0%7B%2C%7D54V%5C%5C%0AKatodi%3A%5C%20Lyijy%26Katodi%3A%5C%20Vety%26Katodi%3A%5C%20Vety%5C%5C%0AAnodi%3A%5C%20Happi%26Anodi%3A%5C%20Happi%26Anodi%3A%5C%20Jodi%5C%5C%0AA%26B%26B%0A%5Cend%7Barray%7D)
2.39

)
)
)



%5Crightarrow%20Ag%5E%2B%5Cleft(aq%5Cright)%2Be%5E-)

)
%3D%5Cfrac%7BN%7D%7BN_A%7D%3D%5Cfrac%7B6%7B%2C%7D0%5Ccdot10%5E6%7D%7B6%7B%2C%7D0221415%5Ccdot10%5E%7B23%7D%5C%20%5Cfrac%7B1%7D%7Bmol%7D%7D%3D9%7B%2C%7D963...%5Ccdot10%5E%7B-18%7Dmol)

%3D%5Cfrac%7Bm_%7BAl%7D%7D%7BM_%7BAl%7D%7D%3D%5Cfrac%7B1000%5C%20g%7D%7B26%7B%2C%7D98%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D37%7B%2C%7D06449222%5C%20mol)
%5Crightarrow%20Al%5E%7B3%2B%7D%5Cleft(aq%5Cright)%2B3e%5E-)

2.40
a)%2Be%5E-%5Crightarrow%20Ag%5Cleft(s%5Cright)%7B%2C%7D%5C%20E_p%3D0%7B%2C%7D80V%26%5C%5C%0A%26NO%5E-%5C%20ei%5C%20reaktiota%26%5C%5C%0A%26Katodi%3A%5C%20Ag%26%5C%5C%0A%26Anodi%3A%5C%20Happi%26%0A%5Cend%7Barray%7D)

)
)
)


%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B6%7B%2C%7D2%5C%20g%7D%7B107%7B%2C%7D87%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D0%7B%2C%7D057476...%5Capprox0%7B%2C%7D05748%5C%20mol)

%3D%5Cfrac%7BIt%7D%7BzF%7D%3D%5Cfrac%7B3%7B%2C%7D077A%5Ccdot1800s%7D%7B4%5Ccdot96485%5C%20%5Cfrac%7BAs%7D%7Bmol%7D%7D%3D0%7B%2C%7D0143509...mol)
%3Dn%5Ccdot%20Vm%3D0%7B%2C%7D143509...mol%5Ccdot22%7B%2C%7D41%5C%20%5Cfrac%7Bl%7D%7Bmol%7D%3D0%7B%2C%7D321604...%5Capprox0%7B%2C%7D32l)
%2B3e%5E-%5Crightarrow%20Au%5Cleft(s%5Cright))
%3D%5Cfrac%7BIt%7D%7BzF%7D%3D%5Cfrac%7B3%7B%2C%7D077A%5Ccdot1800s%7D%7B3%5Ccdot96485%5C%20%5Cfrac%7BAs%7D%7Bmol%7D%7D%3D0%7B%2C%7D0191345...mol)

2.41
2.42
2.43
a)
Katodireaktio:
Anodireaktio:
b)
Katodireaktio:
Anodireaktio:
c)
Katodireaktio:
Anodireaktio:
2.31
1. Anodi, Positiivinen elektrodi, Hapettuminen
2. Katodi, Negatiivinen elektrodi, Pelkistyminen,
3. Kationien kulkusuunta
4. Tasavirtalähde
5. Anionien kulkusuunta
6. Elektrolyytti
2.32
a)
b)
Katodireaktio:
Anodireaktio:
c)
Reaktio ei ole spontaani
Reaktio vaati 3,44V vähimmäisjännitettä.
2.35
2.39
a)
b)
c)
2.40
a)
b)
c)
d)
2.41
2.42
2.43
Kpl 2.3
2.19
a) Oikein
b) Väärin
c) Väärin
d) Oikein
e) Oikein
f) Väärin
g) Oikein
h) Oikei
i) Oikein
2.20
%5C%5C%0A%5Chline%0A%5Cfrac%7BMg%5Cleft(s%5Cright)%7D%7BMg%5E%7B2%2B%7D%5Cleft(aq%5Cright)%7D%5C%20ja%5C%20%5Cfrac%7BAl%5Cleft(s%5Cright)%7D%7BAl%5E%7B3%2B%7D%5Cleft(aq%5Cright)%7D%26%5Cfrac%7BMg%5Cleft(s%5Cright)%7D%7BMg%5E%7B2%2B%7D%5Cleft(aq%5Cright)%7D%26%5Cfrac%7BAl%5Cleft(s%5Cright)%7D%7BAl%5E%7B3%2B%7D%5Cleft(aq%5Cright)%7D%26Mg%5Cleft(s%5Cright)%5Crightarrow%20Mg%5E%7B2%2B%7D%5Cleft(aq%5Cright)%2Be%5E%7B2-%7D%26Al%5E%7B3%2B%7D%5Cleft(aq%5Cright)%2Be%5E%7B3-%7D%5Crightarrow%20Al%5Cleft(s%5Cright)%263Mg%5Cleft(s%5Cright)%2B2Al%5E%7B3%2B%7D%5Cleft(aq%5Cright)%5Crightarrow3Mg%5E%7B2%2B%7D%2B2Al%5Cleft(s%5Cright)%26%2B2%7B%2C%7D37-1%7B%2C%7D66%3D0%7B%2C%7D71V%5C%5C%0A%5Cfrac%7BPt%5Cleft(s%5Cright)%7D%7BPt%5E%7B2%2B%7D%5Cleft(aq%5Cright)%7D%5C%20ja%5C%20%5Cfrac%7BSn%5Cleft(s%5Cright)%7D%7BSn%5E%7B2%2B%7D%5Cleft(aq%5Cright)%7D%26%5Cfrac%7BSn%5Cleft(s%5Cright)%7D%7BSn%5E%7B2%2B%7D%5Cleft(aq%5Cright)%7D%26%5Cfrac%7BPt%5Cleft(s%5Cright)%7D%7BPt%5E%7B2%2B%7D%5Cleft(aq%5Cright)%7D%26Sn%5Cleft(s%5Cright)%5Crightarrow%20Sn%5E%7B2%2B%7D%5Cleft(aq%5Cright)%2Be%5E%7B2-%7D%26Pt%5E%7B2%2B%7D%5Cleft(aq%5Cright)%2Be%5E%7B2-%7D%5Crightarrow%20Pt%5Cleft(s%5Cright)%26Sn%5Cleft(s%5Cright)%2BPt%5E%7B2%2B%7D%5Cleft(aq%5Cright)%5Crightarrow%20Sn%5E%7B2%2B%7D%5Cleft(aq%5Cright)%2BPt%5Cleft(s%5Cright)%260%7B%2C%7D14%2B1%7B%2C%7D18%3D1%7B%2C%7D32V%0A%5Cend%7Barray%7D)
2.21
)
2.22
%5Cmid%20Zn%5E%7B2%2B%7D%5Cleft(aq%5Cright)%5Cmid%5Cmid%20Ag%5E%2B%5Cleft(aq%5Cright)%5Cmid%20Ag%5Cleft(s%5Cright)%2B)
%2B2Ag%5E%2B%5Cleft(aq%5Cright)%5Crightarrow%20Zn%5E%7B2%2B%7D%5Cleft(aq%5Cright)%2BAg%5Cleft(s%5Cright))

2.23
a) Kupari, koska se on nikkeliä jalompi
b) Nikkelistä kupariin
c)%5Crightarrow%20Ni%5E%7B2%2B%7D%5Cleft(aq%5Cright)%2B2e%5E-)
%2B2e%5E-%5Crightarrow%20Cu%5Cleft(s%5Cright))
d) Suolasilta
2.24
a)
%2BHgO%5Cleft(s%5Cright)%5Crightarrow%20Hg%5Cleft(l%5Cright)%2BZnO%5Cleft(s%5Cright))
a) Oikein
b) Väärin
c) Väärin
d) Oikein
e) Oikein
f) Väärin
g) Oikein
h) Oikei
i) Oikein
2.20
2.21
1. Negatiivinen kohtio, Anodi, Hapettuminen
2.3.)
4. Suolasilta
5. Jännitemittari
6. Positiivinen kohtio, Katodi, Pelkistyminen
2.22
2.23
a) Kupari, koska se on nikkeliä jalompi
b) Nikkelistä kupariin
c)
d) Suolasilta
2.24
a)
b)

Kpl 2.2
2.12
 b)
b)


a)
c)

d)

e)

f)
2.13
b) ja c)
%2B2Ag%5E%2B%5Cleft(aq%5Cright)%5Crightarrow%20Ni%5E%7B2%2B%7D%5Cleft(s%5Cright)%2B2Ag%5Cleft(aq%5Cright))
%2BAu%5E%7B3%2B%7D%5Cleft(aq%5Cright)%5Crightarrow3Ag%5E%2B%5Cleft(s%5Cright)%2BAu%5Cleft(aq%5Cright))
2.14
a) Tapahtuu
%2BCuSO_4%5E%7B2%2B%7D%5Cleft(aq%5Cright)%5Crightarrow%20FeSO_4%5Cleft(aq%5Cright)%2BCu%5Cleft(s%5Cright)) b) Ei tapahtu
b) Ei tapahtu
c) Tapahtuu
%2B4HCl%5Cleft(aq%5Cright)%5Crightarrow%20SnCl_4%5Cleft(aq%5Cright)%2B2H_2%5Cleft(g%5Cright))
b) ja c)
b)
0 +I +II 0
c)
0 +III +I 0
2.14
a) Tapahtuu
0 +III+IV-II +II+VI-II 0
c) Tapahtuu
0 +I-I +IV-I +I
Kpl 2.1
2.1

a) Hapettuminen. Orgaanisen yhdisteen hapettaessa hapen määrä kasvaa.
b) Hapettuminen. Alkuaine hapettuu, kun sen haptusluku kasvaa.
c) Pelkistyminen. Alkuaine pelkistyy, kun se vastaanottaa elektroneja.
2.4
Kalsium hapettuu reaktiossa b ja d. Molemmissa reaktiossa kalsiumin haptusluku kasvaa (0->+II)
2.5
a)
Cu +II
O -IV
S -II
+
K +I
I -1
Cu +I
I -I
K +I
S +VI
O +II
I 0
Jodi Hapettuu
Kupari pelkistyy
b)
N -III
H +I
+
Cl 0
N -III
Cl +I
+
H +I
Cl -I
Typpi hapettuu
Kloori pelkistyy
c)
I 0
S +IV
O -II
+
H +I
O -II
H +I
I -I
H +I
S +VI
O -I
Rikki hapettuu
Jodi pelkistyy
d)
Mn +IV
O -II
+
H +I
Cl -I
Mn +II
Cl -I
Cl 0
H -I
O -Ii
Kloori hapettuu
Mangaani pelkistyy
e)
Fe +II
+
Mn +VII
O -II
+
H +I
Fe +III
Mn +II
H+I
O-II
Rauta hapettuu
Mangaani pelkistyy
2.6
%2BCO%5Cleft(g%5Cright)%5Crightarrow%20Pb%5Cleft(s%5Cright)%2BCO_2%5Cleft(g%5Cright))
%2B2Fe%5E%7B3%2B%7D%5Cleft(aq%5Cright)%5Crightarrow%20Sn%5E%7B4%2B%7D%5Cleft(aq%5Cright)%2B2Fe%5E%7B2%2B%7D%5Cleft(aq%5Cright)) Tina hapettuu +II→+IV
Tina hapettuu +II→+IV
%2B2NO_3%5E-%5Cleft(aq%5Cright)%2B4H%5E%2B%5Cleft(aq%5Cright)%5Crightarrow%20Cu%5E%7B2%2B%7D%2B2NO_2%5Cleft(g%5Cright)%2B2H_2O%5Cleft(l%5Cright))
%2B3SO_3%5E%7B2-%7D%5Cleft(aq%5Cright)%2B8H%5E%2B%5Cleft(aq%5Cright)%5Crightarrow2Cr%5E%7B3%2B%7D%2B3SO_4%5E%7B2-%7D%5Cleft(aq%5Cright)%2B4H_2O%5Cleft(l%5Cright))
2.7
%2B8H%5E%2B%5Cleft(aq%5Cright)%5Crightarrow5Fe%5E%7B3%2B%7D%5Cleft(aq%5Cright)%2BMn%5E%7B2%2B%7D%5Cleft(aq%5Cright)%2B4H_2O%5Cleft(l%5Cright))
hapanta vesi liuosta.
c)
%3D0%7B%2C%7D0200%5C%20%5Cfrac%7Bmol%7D%7Bdm%5E3%7D)
%3D8%7B%2C%7D20ml%3D0%7B%2C%7D0820dm%5E3)
%3D%5Cfrac%7B55%7B%2C%7D85g%7D%7Bmol%7D)
%3D%3F)
%3Dn%5Cleft(KMnO_4%5Cright)%3Dc%5Cleft(KMnO_4%5Cright)%5Ccdot%20V%5Cleft(KMnO_4%5Cright))

%3D5%5Ccdot%20n%5Cleft(MnO_4%5Cright)%3D5%5Ccdot1%7B%2C%7D6400%5Ccdot10%5E%7B-3%7D%3D8%7B%2C%7D2000%5Ccdot10%5E%7B-3%7Dmol)
%3Dn%5Cleft(Fe%5E%7B2%2B%7D%5Cright)%5Ccdot%20M%5Cleft(Fe%5E%7B2%2B%7D%5Cright)%3D8%7B%2C%7D2000%5Ccdot10%5E%7B-3%7D%5Ccdot55%7B%2C%7D85%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%3D0%7B%2C%7D45797g%5Capprox458mg)
2.9
%2B4HNO_3%5Cleft(aq%5Cright)%5Crightarrow3AgNO_3%5Cleft(aq%5Cright)%2B2H_2O%5Cleft(l%5Cright)%2BNO%5Cleft(g%5Cright))
%3D129mg%3D0%7B%2C%7D120g)
%3D107%7B%2C%7D87%5C%20%5Cfrac%7Bg%7D%7Bmol%7D)

%3D%3F)
%3D%5Cfrac%7Bm%5Cleft(Ag%5Cright)%7D%7BM%5Cleft(Ag%5Cright)%7D%3D%5Cfrac%7B0%7B%2C%7D120g%7D%7B107%7B%2C%7D87%5C%20%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D1%7B%2C%7D1125%5Ccdot10%5E%7B-3%7Dmol)
%7D%7Bn%5Cleft(Ag%5Cright)%7D%3D%5Cfrac%7B1%7D%7B3%7D%5CRightarrow%20n%5Cleft(NO%5Cright)%3D%5Cfrac%7B1%7D%7B3%7D%5Ccdot%20n%5Cleft(Ag%5Cright)%3D%5Cfrac%7B1%7D%7B3%7D%5Ccdot1%7B%2C%7D1125%5Ccdot10%5E%7B-3%7Dmol%3D3%7B%2C%7D7083%5Ccdot10%5E%7B-4%7Dmol)
%3Dn%5Cleft(NO%5Cright)%5Ccdot%20Vm%3D3%7B%2C%7D7083%5Ccdot10%5E%7B-4%7Dmol%5Ccdot22%7B%2C%7D41dm%5E3%3D8%7B%2C%7D3103%5Ccdot10%5E%7B-3%7Ddm%5E3%5Capprox8%7B%2C%7D31ml)
2.11
2.2
_2%26%2BV%5C%5C%0ACH_3CH_2OH%26%0A%5Cend%7Barray%7D)
2.3a) Hapettuminen. Orgaanisen yhdisteen hapettaessa hapen määrä kasvaa.
b) Hapettuminen. Alkuaine hapettuu, kun sen haptusluku kasvaa.
c) Pelkistyminen. Alkuaine pelkistyy, kun se vastaanottaa elektroneja.
2.4
Kalsium hapettuu reaktiossa b ja d. Molemmissa reaktiossa kalsiumin haptusluku kasvaa (0->+II)
2.5
a)
Cu +II
O -IV
S -II
+
K +I
I -1
Cu +I
I -I
K +I
S +VI
O +II
I 0
Jodi Hapettuu
Kupari pelkistyy
b)
N -III
H +I
+
Cl 0
N -III
Cl +I
+
H +I
Cl -I
Typpi hapettuu
Kloori pelkistyy
c)
I 0
S +IV
O -II
+
H +I
O -II
H +I
I -I
H +I
S +VI
O -I
Rikki hapettuu
Jodi pelkistyy
d)
Mn +IV
O -II
+
H +I
Cl -I
Mn +II
Cl -I
Cl 0
H -I
O -Ii
Kloori hapettuu
Mangaani pelkistyy
e)
Fe +II
+
Mn +VII
O -II
+
H +I
Fe +III
Mn +II
H+I
O-II
Rauta hapettuu
Mangaani pelkistyy
2.6
a)
+II-II +II-II 0 +IV-II
Hiili hapettuu +II→+IV
Lyijy pelkistyy +II→0
b)
+II +III +IV +II
Rauta pelkistyy +III→+II
c)
0 +V-II +I +II +IV-II +I-II
Kupari hapettuu 0→+II
Typpi pelkistyy +V→+IV
d)
+VI-II +IV-II +I +III +VI-II +I-II
Rikki hapettuu +IV→+VI
Kromi pelkistyy +VI→+III
2.7
a)
+II +VII-II +I +III +II +I-II
Rauta hapettuu +II→+III
Mangaani pelkistyy +VII+II
b)hapanta vesi liuosta.
c)
Tasapainotetun reaktioyhtälön perusteella
2.9
a)
0 +I+V-II +I+V-II +I-II +II-II
Hopea hapettuu 0→+I
Typpi pelkistyy +V→+II
b)
Tasapainotetun reaktioyhtälön perusteella
Kpl 1.3
1.11
a)

1.12
a)
Li
b)
At
c)
Cs
d)
Be
e)
Cl
1.13
a) Alumiini ja natrium kuuluvat samaan jaksoon (jakso 3) eli molempien atomien uloimmat elektonit ovat samalla kuorella (keskimäärin yhtä etäällä ytimestä). Alumiiniatomin ytimessä on enemmän protoneja, jotka vetävät ulkoelektroneja puoleensa voimakkaammin, minkä seurauksena atomin koko pienenee.
b) Jodiatomissa on enemmän elektroneja, jotka asettuvat viidelle elektronikuorelle (jakson 5 alkuaine). Klooriatomin elektronit ovat kolmella kuorella (jakson 3 alkuaine), joten klooriatomi on pienempi.
1.14
Magnesiumatomin elektronirakenne on . Uloimmalla kuorella eli kauimpana ytimestä on kaksi elektronia
. Uloimmalla kuorella eli kauimpana ytimestä on kaksi elektronia ) . Näiden irrotamiseen tarvitaan vähemmän energiaa kuin kolmannen elektronin irrottamiseen. Kolmas elektroni tulisi irrottaa
. Näiden irrotamiseen tarvitaan vähemmän energiaa kuin kolmannen elektronin irrottamiseen. Kolmas elektroni tulisi irrottaa  -ionista, jolla on pysyvä , neonin oktettirakenetta vastaava ulkoelektronirakenne
-ionista, jolla on pysyvä , neonin oktettirakenetta vastaava ulkoelektronirakenne  .
.
%5Crightarrow%20Mg%5E%2B%5Cleft(g%5Cright)%2Be%5E-)
%5Crightarrow%20Mg%5E%7B2%2B%7D%5Cleft(g%5Cright)%2Be%5E-)
%5Crightarrow%20Mg%5E%7B3%2B%7D%5Cleft(g%5Cright)%2Be%5E-)
1.15
 , koska tässä tapauksessa kloori-atomi vastaan ottaa yhden elektronin, ja sen seurauksena atomi suurenee
, koska tässä tapauksessa kloori-atomi vastaan ottaa yhden elektronin, ja sen seurauksena atomi suurenee
 , koska kloori ytimessä on enemmän protoneja, jotka vetävät ulkoelektroneja puoleensa voimakkaammin, minkä seurauksena atomin koko pienenee.
, koska kloori ytimessä on enemmän protoneja, jotka vetävät ulkoelektroneja puoleensa voimakkaammin, minkä seurauksena atomin koko pienenee.
 , koska
, koska  muodostuu vain silloin, kun Na luovuttaa yhden elektronin, mikä vaikuttaa atomin kokoon.
muodostuu vain silloin, kun Na luovuttaa yhden elektronin, mikä vaikuttaa atomin kokoon.
 , koska kaliumilla on yksinkertaisesti enemmän eletronikuoria kuin natriumilla.
, koska kaliumilla on yksinkertaisesti enemmän eletronikuoria kuin natriumilla.
1.16
a)
736
b)
1450
c)
494
d)
4560
V: d), koska kun natriumilla on 11 ulko elekrtonia, 2 sisäkuorella, 8 toisella kuorella ja 1 uloimmalla kuorella. Kun siitä halutaan 2 elektronia, toisen kuoren oktetin rikkomiseen tarvitaan enemmän energia.
1.17
Alumiini Al: 13/2-8-1 -44kJ/mol
Fosfori P: 15/2-8-3 -74kJ/mol
Rikki S: 16/2-8-6 -200 kJ/mol
Kloori Cl: 17/2-8-7 -349 kJ/mol
Alukuaineet kuuluvat samaan jaksoon, joten epämetalliluonne kasvaa jaksossa oikealle mentäessä. Elektroniaffiniteettiarvo on sitä suurempi (energiaa vapautuu enemmän), mitä epämetallisempi alkuaine on eli mitä helpommin negatiivinen ioni muodostuu.
1.18
a)
X:llä 7
Y:llä 3
b)
X: 17. ryhmä
Y: 13. ryhmä
c)
Y hapettuu
X pelkistyy
d)
YX3-
e)




a)

1.12
a)
Li
b)
At
c)
Cs
d)
Be
e)
Cl
1.13
a) Alumiini ja natrium kuuluvat samaan jaksoon (jakso 3) eli molempien atomien uloimmat elektonit ovat samalla kuorella (keskimäärin yhtä etäällä ytimestä). Alumiiniatomin ytimessä on enemmän protoneja, jotka vetävät ulkoelektroneja puoleensa voimakkaammin, minkä seurauksena atomin koko pienenee.
b) Jodiatomissa on enemmän elektroneja, jotka asettuvat viidelle elektronikuorelle (jakson 5 alkuaine). Klooriatomin elektronit ovat kolmella kuorella (jakson 3 alkuaine), joten klooriatomi on pienempi.
1.14
Magnesiumatomin elektronirakenne on
1.15
a)
b)
c)
d)
1.16
a)
736
b)
1450
c)
494
d)
4560
V: d), koska kun natriumilla on 11 ulko elekrtonia, 2 sisäkuorella, 8 toisella kuorella ja 1 uloimmalla kuorella. Kun siitä halutaan 2 elektronia, toisen kuoren oktetin rikkomiseen tarvitaan enemmän energia.
1.17
Alumiini Al: 13/2-8-1 -44kJ/mol
Fosfori P: 15/2-8-3 -74kJ/mol
Rikki S: 16/2-8-6 -200 kJ/mol
Kloori Cl: 17/2-8-7 -349 kJ/mol
Alukuaineet kuuluvat samaan jaksoon, joten epämetalliluonne kasvaa jaksossa oikealle mentäessä. Elektroniaffiniteettiarvo on sitä suurempi (energiaa vapautuu enemmän), mitä epämetallisempi alkuaine on eli mitä helpommin negatiivinen ioni muodostuu.
1.18
a)
X:llä 7
Y:llä 3
b)
X: 17. ryhmä
Y: 13. ryhmä
c)
Y hapettuu
X pelkistyy
d)
YX3-
e)
Kpl 1.1-1.2
1.1

1.2
a) 2
b) Sn
c) 17
d) p
e) 3
f) +II
g) Tc
h) Ge
1.3
a) jakso 5 ryhmä 16
b) jakso 4 ryhmä 7, Mn
c) jakso 5 ryhmä 11, Ag
d) jakso 3 ryhmä 15, P
e) Jakso 6 ryhmä 2, Ba
1.4
a) Titaani
b) Cr
c) S
d) Sr
e) P
1.5
a)

b)

1.6
Elektronegatiivisuus kuvaa kemiallisesti sitoutuneen atomin kykyä vetää puoleensa sidoselektroneja. Jalokaasujen pysyvän ulkoelektronirakenteen vuoksi ne muodostavat hyvin vaikeasti yhdisteitä.
1.8%26Ioniyhdiste%26Molekyyliyhdiste%5C%5C%0A%5Chline%0AK%5C%20ja%5C%20F%263%7B%2C%7D2%2692%5C%25%26x%26%5C%5C%0AAl%5C%20ja%5C%20O%262%7B%2C%7D0%2663%5C%25%26x%26%5C%5C%0AS%5C%20ja%5C%20O%261%7B%2C%7D0%2622%5C%25%26%26x%5C%5C%0AN%5C%20ja%5C%20Cl%260%260%5C%25%26%26x%0A%5Cend%7Barray%7D)
1.2
a) 2
b) Sn
c) 17
d) p
e) 3
f) +II
g) Tc
h) Ge
1.3
a) jakso 5 ryhmä 16
b) jakso 4 ryhmä 7, Mn
c) jakso 5 ryhmä 11, Ag
d) jakso 3 ryhmä 15, P
e) Jakso 6 ryhmä 2, Ba
1.4
a) Titaani
b) Cr
c) S
d) Sr
e) P
1.5
a)

b)

1.6
Elektronegatiivisuus kuvaa kemiallisesti sitoutuneen atomin kykyä vetää puoleensa sidoselektroneja. Jalokaasujen pysyvän ulkoelektronirakenteen vuoksi ne muodostavat hyvin vaikeasti yhdisteitä.
1.8