3. Yhdistetyypit
Yhdistetyypit
Harva asia, mitä näet ympärilläsi, koostuu puhtaasti yhdestä alkuaineesta. Useimmiten aine koostuu useammasta alkuaineesta, jotka muodostavat yhdisteen. Atomien elektronirakenne liittyy vahvasti yhdisteiden muodostumiseen.
Tässä kappaleessa tarkastellaan kahta eri yhdistetyyppiä: ioniyhdisteitä ja molekyyliyhdisteitä.
 Ruokasuola, eli natriumkloridi, on ioniyhdiste, sillä se muodostuu natriumin (metalli) ja kloorin (epämetalli) reagoidessa keskenään.
Ruokasuola, eli natriumkloridi, on ioniyhdiste, sillä se muodostuu natriumin (metalli) ja kloorin (epämetalli) reagoidessa keskenään.
Ioni
Ioni on atomi, joka on luovuttanut tai vastaanottanut yhden tai useamman elektronin. Jos atomi luovuttaa yhden tai useamman elektronin, niin siitä tulee positiivisesti varautunut. Tämä johtuu siitä, että positiivisesti varautuneita protoneja on ionissa enemmän kuin negatiivisesti varautuneita elektroneja. Jos taas atomi vastaanottaa yhden tai useamman elektronin, niin siitä tulee negatiivisesti varautunut ioni.
Metallit, kuten natrium alla, pyrkivät pääsääntöisesti luopumaan ulkoelektroneistaan, joilloin niistä tulee positiivisia ioneja.
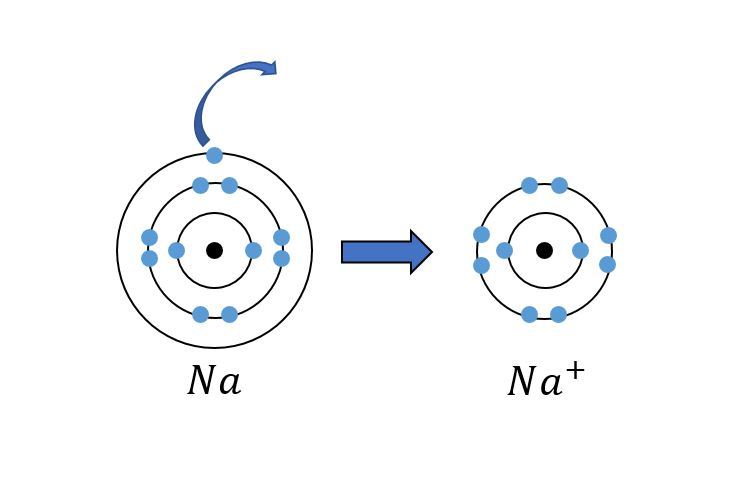 Natriumiatomin uloimmalla tasolla on yksi elektroni. Helpoin tapa, jolla natriumatomi saavuttaa oktetin, on luovuttaa ainoa ulkoelektroni pois, jolloin jo valmiiksi täynnä oleva toinen energiataso muuttuu uloimmaksi. Tällöin natriumatomista tulee positiivinen natriuioni [[$Na^+$]].
Natriumiatomin uloimmalla tasolla on yksi elektroni. Helpoin tapa, jolla natriumatomi saavuttaa oktetin, on luovuttaa ainoa ulkoelektroni pois, jolloin jo valmiiksi täynnä oleva toinen energiataso muuttuu uloimmaksi. Tällöin natriumatomista tulee positiivinen natriuioni [[$Na^+$]].
Epämetallit, kuten kloori alla, pyrkivät pääsääntöisesti vastaanottamaan elektroneja, joilloin niistä tulee negatiivisia ioneja.
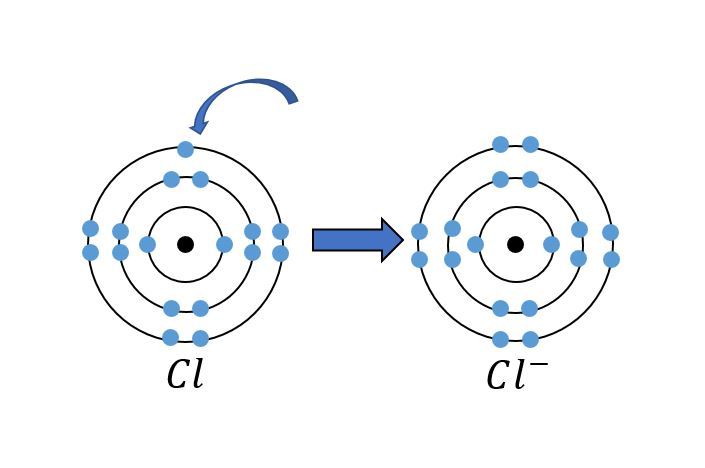 Klooriatomin uloimmalla tasolla on seitsemän elektronia. Helpoin tapa, jolla klooriatomi saavuttaa oktetin, on vastaanottaa yksi elektroni. Tällöin klooriatomista tulee negatiivinen kloridi-ioni [[$Cl^-$]].
Klooriatomin uloimmalla tasolla on seitsemän elektronia. Helpoin tapa, jolla klooriatomi saavuttaa oktetin, on vastaanottaa yksi elektroni. Tällöin klooriatomista tulee negatiivinen kloridi-ioni [[$Cl^-$]].
Ioniyhdiste
Metalliatomit haluavat luopua elektroneistaan ja epämetalli-ionit haluavat vastaanottaa elektroneja.
Mitä tapahtuu kun metalli kohtaa epämetallin? Tällöin on todennäköistä, että ne reagoivat keskenään metallin luovuttaessa ja epämetallin vastaanottaessa yhden tai useamman elektronin. Positiivisen metalli-ionin ja negatiivisen epämetalli-ionin välille syntyy sähköinen vetovoima jolloin syntyy ioniyhdiste.
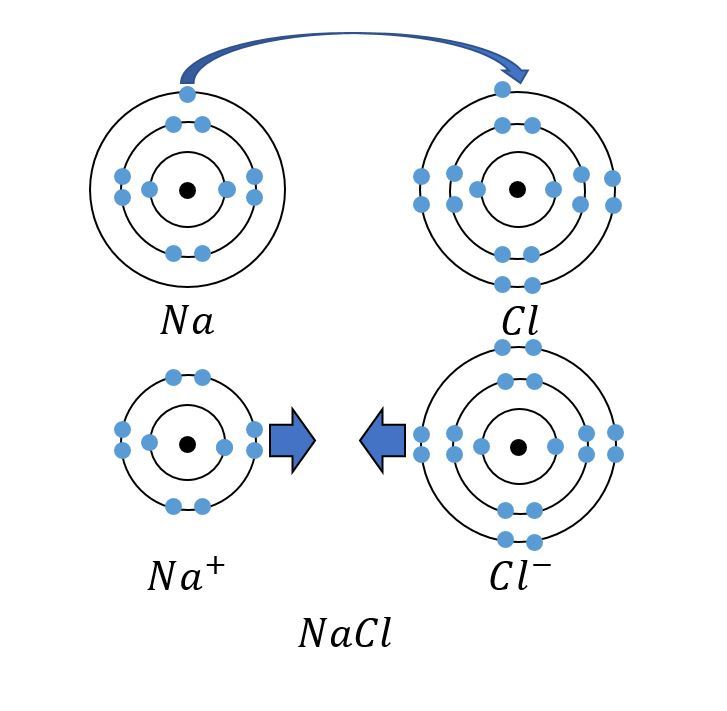 Natriumatomi luovuttaa klooriatomille elektronin. Molemmat saavuttavat oktetin ja erimerkkiset ionit vetävät toisiaan puoleensa muodostaen natriumkloridia eli ruokasuolaa.
Natriumatomi luovuttaa klooriatomille elektronin. Molemmat saavuttavat oktetin ja erimerkkiset ionit vetävät toisiaan puoleensa muodostaen natriumkloridia eli ruokasuolaa.
Ioniyhdisteitä kutsutaan myös suoloiksi. Ioniyhdisteillä on korkeat sulamispisteet, joten ne ovat huoneenlämmössä kiinteitä ja rakenteeltaan ne ovat kiteisiä. Veteen liuetessaan ioniyhdisteet hajoavat erillisiksi ioneiksi, jotka voivat kuljettaa sähköä. Tästä syystä ioniyhdisteet johtavat sähköä liuoksina.
Molekyyliyhdiste
Epämetallit esiintyvät harvoin yksittäisinä atomeina. Esimerkiksi happi, [[$O$]], esiintyy lähes aina kaksiatomisena molekyylinä [[$O_2$]]. Epämetalliatomit yhdistyvät toisiinsa kovalenttisin sidoksin. Kovalenttisessa sidoksessa epämetalliatomit luovuttavat yhden tai useamman ulkoelektronin yhteiseen käyttöön, jotta kaikki atomit saavuttaisivat oktetin.
Molekyyliyhdiste muodostuu kun kaksi tai useampi eri epämetallia liittyvät toisiinsa kovalenttisin sidoksin kaikkien yhdisteen atomien saavuttaessa oktetin. Molekyyliyhdiste ei muodostu ioneista ja on siksi sähköisesti neutraali.
Ominaisuuksiltaan molekyyliyhdisteet ovat vaihtelevia. Ne voivat olla kiinteitä, nesteitä tai kaasuja ja ne saattavat johtaa sähköä liuoksina.
 Vesi on molekyyliyhdiste, joka muodostuu kahden vetyatomin liittyessä happiatomiin kovalenttisin sidoksin. Vesi on huoneenlämmössä neste eikä johda sähköä.
Vesi on molekyyliyhdiste, joka muodostuu kahden vetyatomin liittyessä happiatomiin kovalenttisin sidoksin. Vesi on huoneenlämmössä neste eikä johda sähköä.
Tässä kappaleessa tarkastellaan kahta eri yhdistetyyppiä: ioniyhdisteitä ja molekyyliyhdisteitä.
 Ruokasuola, eli natriumkloridi, on ioniyhdiste, sillä se muodostuu natriumin (metalli) ja kloorin (epämetalli) reagoidessa keskenään.
Ruokasuola, eli natriumkloridi, on ioniyhdiste, sillä se muodostuu natriumin (metalli) ja kloorin (epämetalli) reagoidessa keskenään.Ioni
Ioni on atomi, joka on luovuttanut tai vastaanottanut yhden tai useamman elektronin. Jos atomi luovuttaa yhden tai useamman elektronin, niin siitä tulee positiivisesti varautunut. Tämä johtuu siitä, että positiivisesti varautuneita protoneja on ionissa enemmän kuin negatiivisesti varautuneita elektroneja. Jos taas atomi vastaanottaa yhden tai useamman elektronin, niin siitä tulee negatiivisesti varautunut ioni.
Metallit, kuten natrium alla, pyrkivät pääsääntöisesti luopumaan ulkoelektroneistaan, joilloin niistä tulee positiivisia ioneja.
 Natriumiatomin uloimmalla tasolla on yksi elektroni. Helpoin tapa, jolla natriumatomi saavuttaa oktetin, on luovuttaa ainoa ulkoelektroni pois, jolloin jo valmiiksi täynnä oleva toinen energiataso muuttuu uloimmaksi. Tällöin natriumatomista tulee positiivinen natriuioni [[$Na^+$]].
Natriumiatomin uloimmalla tasolla on yksi elektroni. Helpoin tapa, jolla natriumatomi saavuttaa oktetin, on luovuttaa ainoa ulkoelektroni pois, jolloin jo valmiiksi täynnä oleva toinen energiataso muuttuu uloimmaksi. Tällöin natriumatomista tulee positiivinen natriuioni [[$Na^+$]].Epämetallit, kuten kloori alla, pyrkivät pääsääntöisesti vastaanottamaan elektroneja, joilloin niistä tulee negatiivisia ioneja.
 Klooriatomin uloimmalla tasolla on seitsemän elektronia. Helpoin tapa, jolla klooriatomi saavuttaa oktetin, on vastaanottaa yksi elektroni. Tällöin klooriatomista tulee negatiivinen kloridi-ioni [[$Cl^-$]].
Klooriatomin uloimmalla tasolla on seitsemän elektronia. Helpoin tapa, jolla klooriatomi saavuttaa oktetin, on vastaanottaa yksi elektroni. Tällöin klooriatomista tulee negatiivinen kloridi-ioni [[$Cl^-$]].Ioniyhdiste
Metalliatomit haluavat luopua elektroneistaan ja epämetalli-ionit haluavat vastaanottaa elektroneja.
Mitä tapahtuu kun metalli kohtaa epämetallin? Tällöin on todennäköistä, että ne reagoivat keskenään metallin luovuttaessa ja epämetallin vastaanottaessa yhden tai useamman elektronin. Positiivisen metalli-ionin ja negatiivisen epämetalli-ionin välille syntyy sähköinen vetovoima jolloin syntyy ioniyhdiste.
 Natriumatomi luovuttaa klooriatomille elektronin. Molemmat saavuttavat oktetin ja erimerkkiset ionit vetävät toisiaan puoleensa muodostaen natriumkloridia eli ruokasuolaa.
Natriumatomi luovuttaa klooriatomille elektronin. Molemmat saavuttavat oktetin ja erimerkkiset ionit vetävät toisiaan puoleensa muodostaen natriumkloridia eli ruokasuolaa.Ioniyhdisteitä kutsutaan myös suoloiksi. Ioniyhdisteillä on korkeat sulamispisteet, joten ne ovat huoneenlämmössä kiinteitä ja rakenteeltaan ne ovat kiteisiä. Veteen liuetessaan ioniyhdisteet hajoavat erillisiksi ioneiksi, jotka voivat kuljettaa sähköä. Tästä syystä ioniyhdisteet johtavat sähköä liuoksina.
Molekyyliyhdiste
Epämetallit esiintyvät harvoin yksittäisinä atomeina. Esimerkiksi happi, [[$O$]], esiintyy lähes aina kaksiatomisena molekyylinä [[$O_2$]]. Epämetalliatomit yhdistyvät toisiinsa kovalenttisin sidoksin. Kovalenttisessa sidoksessa epämetalliatomit luovuttavat yhden tai useamman ulkoelektronin yhteiseen käyttöön, jotta kaikki atomit saavuttaisivat oktetin.
Molekyyliyhdiste muodostuu kun kaksi tai useampi eri epämetallia liittyvät toisiinsa kovalenttisin sidoksin kaikkien yhdisteen atomien saavuttaessa oktetin. Molekyyliyhdiste ei muodostu ioneista ja on siksi sähköisesti neutraali.
Ominaisuuksiltaan molekyyliyhdisteet ovat vaihtelevia. Ne voivat olla kiinteitä, nesteitä tai kaasuja ja ne saattavat johtaa sähköä liuoksina.
 Vesi on molekyyliyhdiste, joka muodostuu kahden vetyatomin liittyessä happiatomiin kovalenttisin sidoksin. Vesi on huoneenlämmössä neste eikä johda sähköä.
Vesi on molekyyliyhdiste, joka muodostuu kahden vetyatomin liittyessä happiatomiin kovalenttisin sidoksin. Vesi on huoneenlämmössä neste eikä johda sähköä.
