Harjoitustehtävät ja työt
S.152 4-22
S.152 4-21
S.152 4-19
S.146 4-16
a)
Yhdiste on rengasrakenteinen tyydyttymätön hiilivety
b)
Voi olla, koska yhdiste on regasrakenteinen, joka tarkoittaa sitä, että ne hiiliatomien välissä olevat sidokset voivat taippua. Sen lisäksi yhdisteessä myös yksittäisiä C-C-sidoksia, ja nekin pystyvät taippua.
c)
S.146 4-13
A 1
B 1
D 3
E 1
B 1
D 3
E 1
S.145 4-11
a) E
b) Z
c) E
d) Z
b) Z
c) E
d) Z
S.144 4-10
S.144 4-7
BD
EG
EG
S.135 4-5
S.135 4-3
S.134 4-1
a) Sidokset sitoutuvat tasaisesti säännöllisen tetraedrin kärkiin.
b) Sidokset sitoutuvat yhtä kauas toisista, mutta niitä taivuttaa vedyn vapana jäävä elekrtonipari, jolloin kulman suurus pienenee.
c) Vedyn vapana jäävä elektroninpari on taivuttanut sidoskulmaa.
b) Sidokset sitoutuvat yhtä kauas toisista, mutta niitä taivuttaa vedyn vapana jäävä elekrtonipari, jolloin kulman suurus pienenee.
c) Vedyn vapana jäävä elektroninpari on taivuttanut sidoskulmaa.
S.123 3-24
S.123 3-23
S.122 3-22
S.122 3-21
a)
CH3CH2
b)
C-Cl Kloorialkaani 600-800 cm-1
C-H Alkaani, alkeeni, aromaattinen 2850-3100 cm-1
c)
2, koska H-NMR-spektromertisessä tutkimuksessa otetaan huomioon vain vetyjä sisältäviä atomeja.
CH3CH2
b)
C-Cl Kloorialkaani 600-800 cm-1
C-H Alkaani, alkeeni, aromaattinen 2850-3100 cm-1
c)
2, koska H-NMR-spektromertisessä tutkimuksessa otetaan huomioon vain vetyjä sisältäviä atomeja.
S.113 3-15
a)
1-Butanoli 117°C Koska sillä on suora hiiliketju, ja sillä on havhvasti poolinen OH-ryhmä
2-Butanoli 100°C Silläkin on vahava poolinen OH-ryhmä, mutta haaroittunut hiilikejut henkentää dispersiovoiman vaikutusta.
Dietyylieetteri 35°C Ei niin poolinen
b)
Butaanihappo 164°C Koska se on happo, ja sillä on vahva poolinen COOH-ryhmä
Etyyliasetaatti 77°C Ei niin poolinen
c)
Trimetyyliamiini Hyvä, sillä typeen ei ole liitetty vedyn atomeja.
Proppyliamiini Erittäin hyvä, koska typeen on liitetty vedyn atomeja, toisaalta NH2-ryhmä on myös hiiliketjun päässä, ja se vahvista sen liukoisuutta veteen.
1-Butanoli 117°C Koska sillä on suora hiiliketju, ja sillä on havhvasti poolinen OH-ryhmä
2-Butanoli 100°C Silläkin on vahava poolinen OH-ryhmä, mutta haaroittunut hiilikejut henkentää dispersiovoiman vaikutusta.
Dietyylieetteri 35°C Ei niin poolinen
b)
Butaanihappo 164°C Koska se on happo, ja sillä on vahva poolinen COOH-ryhmä
Etyyliasetaatti 77°C Ei niin poolinen
c)
Trimetyyliamiini Hyvä, sillä typeen ei ole liitetty vedyn atomeja.
Proppyliamiini Erittäin hyvä, koska typeen on liitetty vedyn atomeja, toisaalta NH2-ryhmä on myös hiiliketjun päässä, ja se vahvista sen liukoisuutta veteen.
S.112 3-13
S.112 3-12
S.112 3-11
A, E
B, C
B, C
S.106 3-10
a) Pääte -oni viittaa testosteribub rajebteessa olevaan karbonyyliryhmään (ketoryhmään). Yhdisteet, jossa on funktionaalisena ryhmänä ketoryhmä, saavat nimeensä päätteen -oni.
b)
%3D4%7B%2C%7D5l%3D4%7B%2C%7D5kg%3D4500g%3D45000g)
%3D8%7B%2C%7D0mg)
%3D%5Cfrac%7B0%7B%2C%7D008g%7D%7B288%7B%2C%7D42%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D2%7B%2C%7D7737%5Ccdot10%5E%7B-5%7Dmol)

%3D%5Cfrac%7B2%7B%2C%7D7737%5Ccdot10%5E%7B-5%7Dmol%7D%7B4%7B%2C%7D5l%7D%3D6%7B%2C%7D16%5Ccdot10%5E%7B-6%7D%5Cfrac%7Bmol%7D%7Bl%7D)
b)
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
S.106 3-9
S.105 3-7
S.100 3-6
a)

n= Aine määrä (mol)
m= Massa (g)
M= Moolimassa (g/mol)
Lasketaan palaneessa yhdisteessä ollen hiilen ja vedyn massat
Hapen massa
Lasketaan hiilen, vedyn sekä hapen ainemäärien suhde
b)
S.100 3-4
Lasketaan palaneessa yhdisteessä ollen hiilen ja vedyn massat
Hapen massa
Lasketaan hiilen, vedyn sekä hapen ainemäärien suhde
S.100 3-3
Jaetaan kukin ainemäärä pienimmällä eli tässä tapauksessa hapen ainemäärällä
4:4:1
S.100 3-1
a)
)
b)
)
c)
)
d)
)
e)
)
f)
)
b)
c)
d)
e)
f)
S.87 2-37
Koska C-vitamiinilla on lyhyempi hiilikejtu kuin A:lla, A:n pitkä hiilikeju vaikeutta sen liukenemista veteen, ja C- vitamiini on myös selvästi poolisempi kuin A.
S.87 3-36
A 6, 8
B 2, 8
C 3, 7
D 4, 8
E 8
F 5, 8
G 1, 8
B 2, 8
C 3, 7
D 4, 8
E 8
F 5, 8
G 1, 8
S.86 2-33
a) CHO ryhmällä on heikompia dipoli-dipolisidoksia, joiden katkeamiseen tarvitaan vähemmän lämpöenergiaa.
b) -
c) Koska steariinihapolla on aika pitkä pooliton hiiliketju, ja se selitää aika hyvin kyseistä ilmiötä.
d) OH ryhmä on poolisempi, siksi se on huonelämpötilassa nestemuotossa.
b) -
c) Koska steariinihapolla on aika pitkä pooliton hiiliketju, ja se selitää aika hyvin kyseistä ilmiötä.
d) OH ryhmä on poolisempi, siksi se on huonelämpötilassa nestemuotossa.
S.85 2-30
a) Kun vesi ja etanoli sekoitetaan, molekyylien välille muodostuu vetysidoksia, joiden vaikutuksesta etanolimolekyylit pakkaantuvat tiiviiisti vesimolekyylien väliin ja liuoksen kokoaistilavuus pienenee.
b) Glyserolimolekyylissä on kolme poolista hydroksyyliryhmääm joiden kautta se voi muodostaa useampia vetysidoksia toisiin glyserolimolekyyleihin kuin yksiarvoinen etanoli. Suuri vertysidosten määrä glyserolimolekyylien välillä selittää glyserolin jäykkäliikkeisyyden etanoliin verrattuna.
b) Glyserolimolekyylissä on kolme poolista hydroksyyliryhmääm joiden kautta se voi muodostaa useampia vetysidoksia toisiin glyserolimolekyyleihin kuin yksiarvoinen etanoli. Suuri vertysidosten määrä glyserolimolekyylien välillä selittää glyserolin jäykkäliikkeisyyden etanoliin verrattuna.
S.85 2-28
Metanoli: Auton tuulilasin pesunesteessä
Etanoli: Desifiointiaineena liuottimena parfyymeissä ja partavesissä.
Glyseroli: Kosteudensitojana voiteissa ja hammastahnoissa.
Glykoli: Auton jäähdytinnesteessä spriii.keittimessä palavana aineena.
Etanoli: Desifiointiaineena liuottimena parfyymeissä ja partavesissä.
Glyseroli: Kosteudensitojana voiteissa ja hammastahnoissa.
Glykoli: Auton jäähdytinnesteessä spriii.keittimessä palavana aineena.
S.85 2-27
- Sekä alkoholien että alkaanien kiehumispiste nousee, kun hiiliatomien määrä kasvaa.
- Alkoholeilla kiehumispisteen nousu on suoraan verrannollinen hiiliatomien lukumäärää
S.85 2-24
S.73 2-21
a) 2-buteeni (but-2-eeni)
b) heptaani
c) 2,2difluoributaani
d) 3-etyyliheksaani
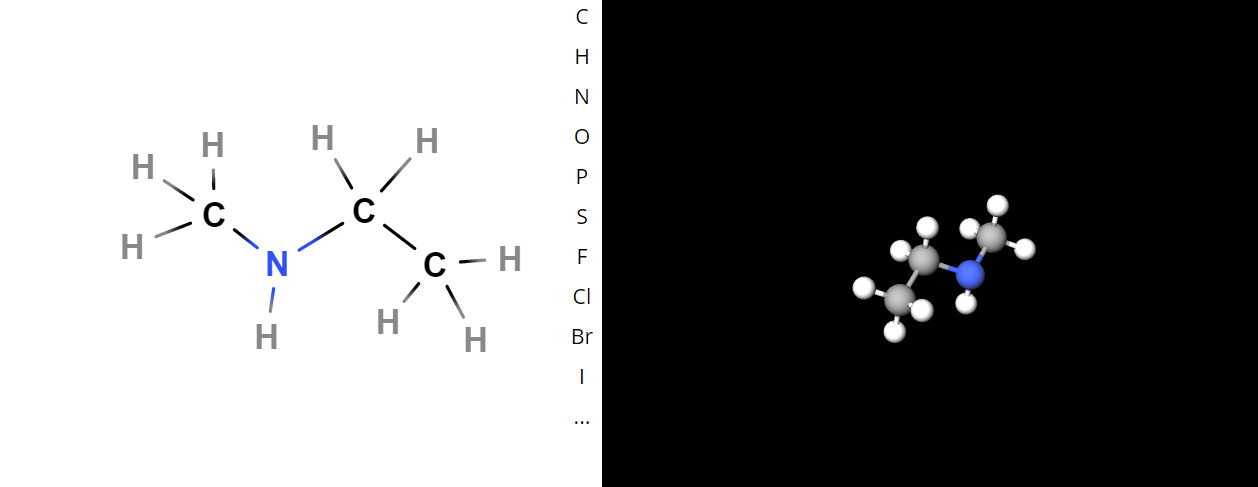
e) Etyylimetyyliamiini
f) 2-aminoetaanihappo
g) Metyylisyklopentaani
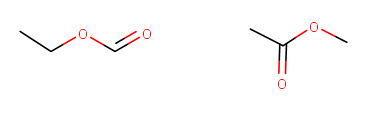
h) Etaanihapon metyyliesteri (metyylietanaatti)
i) 3-nitrofenoli
j) Etyylimetyylieetteri
b) heptaani
c) 2,2difluoributaani
d) 3-etyyliheksaani
e) Etyylimetyyliamiini
f) 2-aminoetaanihappo
g) Metyylisyklopentaani
h) Etaanihapon metyyliesteri (metyylietanaatti)
i) 3-nitrofenoli
j) Etyylimetyylieetteri
S.72 2-20
A 6
B 9
C 5
D 8
E 2
F 1
G 11
H 16
I 15
J 13
B 9
C 5
D 8
E 2
F 1
G 11
H 16
I 15
J 13
S.72 2-16
a) Aromaattinen yhdiste, karboksyylihappo, esteri
b) Aromaattinen yhdiste, karboksyylihappo
c) Parasetamoli: fenoli, amidi
b) Aromaattinen yhdiste, karboksyylihappo
c) Parasetamoli: fenoli, amidi
S.72 2-15
a,d,f koska kaikissa näissä molekyyleissä on funktinaalisena ryhmänä -OH-ryhmä eli ne ovat kaikki alkoholeja.
b,e,g Ne ovat kaikki hiilivetyjä.
c,h koska näissä on funktionaalisena ryhmänä eetteriryhmä eli ne ovat eettereitä.
b,e,g Ne ovat kaikki hiilivetyjä.
c,h koska näissä on funktionaalisena ryhmänä eetteriryhmä eli ne ovat eettereitä.
S.72 2-13
A Kaksoissidos-Alkeeni
B Kertoryhmä/Karbonyyliryhmä-Ketoni
C Eetteri-Eetteri
D Bentsenirengas-Aromaattinen (Hiilivety)
E Aminoryhmä-Amiini
F Bentseenirengas ja karboksyyliryhmä - Aromaattinen karboksyylihappo
G Fenolinen hydroksyyliryhmä (hydroksyyliryhmä kiinni bentseenirenkaassa)-Fenoli
H Koloissidos-Alkyyni
I Esteri-Esteri
J Aminoryhmä ja karboksyyliryhmä-Aminohappo
B Kertoryhmä/Karbonyyliryhmä-Ketoni
C Eetteri-Eetteri
D Bentsenirengas-Aromaattinen (Hiilivety)
E Aminoryhmä-Amiini
F Bentseenirengas ja karboksyyliryhmä - Aromaattinen karboksyylihappo
G Fenolinen hydroksyyliryhmä (hydroksyyliryhmä kiinni bentseenirenkaassa)-Fenoli
H Koloissidos-Alkyyni
I Esteri-Esteri
J Aminoryhmä ja karboksyyliryhmä-Aminohappo
S.71 2-12
1. Alkyyni C
2. Ketoni E
3. Esteri B
4. Eetteri G
5. Amiini A
6. Aldehydi F
7. Amidi D
2. Ketoni E
3. Esteri B
4. Eetteri G
5. Amiini A
6. Aldehydi F
7. Amidi D
S. 62 2-10
b)
S. 62 2-11
a)
b)

c)

n= Aine määrä (mol)
%3D0%7B%2C%7D06g)
%3D162%7B%2C%7D23%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7B0%7B%2C%7D06g%7D%7B162%7B%2C%7D23%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D3%7B%2C%7D698%5Ccdot10%5E%7B-4%7Dmol)


- Heterosyklisessä yhdisteissä on rengasrakenne, jossa on hiliatomien lisäksi myös muita alkuaineatomeja, ja aromaattisessä yhdisteissä on useampia rengasrakenteita.
- Nikotiinissä on hiilen lisäksi myös vedyn ja typen atomit, ja sillä on samalla useampia rengaita.
b)

c)
m= Massa (g)
M= Moolimassa (g/mol)
S.62 2-9
A 5,7
B 1,4
C 2,3
D 2,6
E 2,3
F 1,4
G 5,7
H 2,3 tai 1,4
B 1,4
C 2,3
D 2,6
E 2,3
F 1,4
G 5,7
H 2,3 tai 1,4
S.62 2-8
a)
 -sidosta
-sidosta
b)
 -sidosta ja 1
-sidosta ja 1 -sidos
-sidos
c)
 -sidosta ja
-sidosta ja  -sidosta
-sidosta
d)
 -sidosta ja
-sidosta ja  -sidosta
-sidosta
c)
 -sidosta ja
-sidosta ja  -sidos
-sidos
b)
c)
d)
c)
S.56 2-7
a)
Sublimoituminen on fysiikassa olomuodonmuutos suoraan kiinteästä kaasuksi ilman nestemäistä välitilaa.
b)
Polysykliset aromaattiset hiilivedyt eli PAH-yhdisteet ovat yhteen liittyneistä aromaattisistarenkaista koostuvia hiilivetyjä.
c)

n= Aine määrä (mol)
%3D1%7B%2C%7D0g)
%3D128%7B%2C%7D1705%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B1%7B%2C%7D0g%7D%7B128%7B%2C%7D1705%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D7%7B%2C%7D802%5Ccdot10%5E%7B-3%7Dmol)
d)

n= Aine määrä (mol)
%3D100mg%3D0%7B%2C%7D100g)
%3D128%7B%2C%7D1705%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B0%7B%2C%7D100g%7D%7B128%7B%2C%7D1705%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D7%7B%2C%7D802%5Ccdot10%5E%7B-4%7Dmol)

%3DnN_A%3D7%7B%2C%7D802%5Ccdot10%5E%7B-4%7Dmol%5Ccdot6%7B%2C%7D022%5Ccdot10%5E%7B%5E%7B23%7D%7D%3D4%7B%2C%7D698%5Ccdot10%5E%7B20%7D)

Sublimoituminen on fysiikassa olomuodonmuutos suoraan kiinteästä kaasuksi ilman nestemäistä välitilaa.
b)
Polysykliset aromaattiset hiilivedyt eli PAH-yhdisteet ovat yhteen liittyneistä aromaattisistarenkaista koostuvia hiilivetyjä.
c)
m= Massa (g)
M= Moolimassa (g/mol)
d)
m= Massa (g)
M= Moolimassa (g/mol)
S.56 2-5
S.55 2-4
a)
B, C7O14
b)
C, C9H20
c)
A, C8H10
d)
E, C20H12
e)
D, C5H9O2N
B, C7O14
b)
C, C9H20
c)
A, C8H10
d)
E, C20H12
e)
D, C5H9O2N
S.55 2-2
S.45 1-35
S.45 1-34
m= Massa (g)
M= Moolimassa (g/mol)
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
Lasketaan nyt mitä on pipetoittu liuoksen konsentraatio:
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
S.45 1-33
a)

Liuoksen tulee laimentua 2-kertaisesti.

Siis väkevästä liuoksesta otettavan tilavuuden on oltava tässä tapauksessa 1/2 laimennoksen loppu tilavuudesta eli 100 ml:sta.
Otetaan 50ml täyspipetillä liuosta ja täytetään mittapullo merkkiin asti.
b)

Liuoksen tulee laimentua 4-kertaisesti

Siis väkevästä liuoksesta otettavan tilavuuden on oltava tässä tapauksessa 1/4 laimennoksen loppu tilavuudesta eli 200 ml:sta.
Otetaan 50ml täyspipetillä liuosta ja täytetään mittapullo merkkiin asti.
c)

Liuoksen tulee laimentua 50-kertaisesti.

Siis väkevästä liuoksesta otettavan tilavuuden on oltava tässä tapauksessa 1/50 laimennoksen loppu tilavuudesta eli 200 ml:sta.
Otetaan 1,0ml täyspipetillä liuosta ja täytetään mittapullo merkkiin asti.
Lasketaan konsentraatioiden suhde:
Siis väkevästä liuoksesta otettavan tilavuuden on oltava tässä tapauksessa 1/2 laimennoksen loppu tilavuudesta eli 100 ml:sta.
Otetaan 50ml täyspipetillä liuosta ja täytetään mittapullo merkkiin asti.
b)
Lasketaan konsentraatioiden suhde:
Siis väkevästä liuoksesta otettavan tilavuuden on oltava tässä tapauksessa 1/4 laimennoksen loppu tilavuudesta eli 200 ml:sta.
Otetaan 50ml täyspipetillä liuosta ja täytetään mittapullo merkkiin asti.
c)
Lasketaan konsentraatioiden suhde:
Siis väkevästä liuoksesta otettavan tilavuuden on oltava tässä tapauksessa 1/50 laimennoksen loppu tilavuudesta eli 200 ml:sta.
Otetaan 1,0ml täyspipetillä liuosta ja täytetään mittapullo merkkiin asti.
S.45 1-30
Valmistetaan 100ml natriumkloridiliuosta, jonka kosentraatio on 0,25 mol/l
Lasketaan ensin , kuinka monta moolia nartiumkloridia on liuotettava:
Lasketaan ensin , kuinka monta moolia nartiumkloridia on liuotettava:
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
Lasketaan seuraavaksi, paljonko sakkaroosia on punnittava:
m= Massa (g)
M= Moolimassa (g/mol)
Koska käytettävissä on analyysivaaka, jolla saadaan punnittua 0,001g tarkuudella, punnitaan natriumkloridia 1,460 grammaa.
Punnitaan tarkasti 1,460g natriumkloridia dekantterilasiin. Natriumkloridin sekaan lisätään vettä ja liuosta sekoitetaan kunnes natriumkloridi on täysin liuonnut. Seuraavaksi liuos kaadetaan 100ml mittapulloon. Sekaan lisätään vettä niin, että liuos saavuttaa merkkiviivan.
Punnitaan tarkasti 1,460g natriumkloridia dekantterilasiin. Natriumkloridin sekaan lisätään vettä ja liuosta sekoitetaan kunnes natriumkloridi on täysin liuonnut. Seuraavaksi liuos kaadetaan 100ml mittapulloon. Sekaan lisätään vettä niin, että liuos saavuttaa merkkiviivan.
S.38 1-27
a)
%7B%2C%7D%5C%20tiheys%3D1%7B%2C%7D18%5Cfrac%7Bkg%7D%7Bdm%5E3%7D%7B%2C%7D%5C%20m-%5C%25%3D36%5C%25)

%3D%5Cfrac%7B0%7B%2C%7D36m%7D%7BMV%7D%3D%5Cleft(%5Crho%3D%5Cfrac%7Bm%7D%7BV%7D%5Cright)%3D%5Cfrac%7B0%7B%2C%7D36%5Crho%7D%7BM%7D%3D%5Cfrac%7B%5Cleft(1180%5Cfrac%7Bg%7D%7Bl%7D%5Ccdot0%7B%2C%7D36%5Cright)mol%7D%7B%5Cleft(1%7B%2C%7D008%2B35%7B%2C%7D45%5Cright)%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D11%7B%2C%7D6517...%5Capprox12%5Cfrac%7Bmol%7D%7Bdm%5E3%7D)
b)
%7B%2C%7Dtiheys%3D0%7B%2C%7D91%5Cfrac%7Bkg%7D%7Bdm%5E3%7D%7B%2C%7D%5C%20m-%5C%25%3D25%5C%25)

%3D%5Cfrac%7B0%7B%2C%7D25m%7D%7BMV%7D%3D%5Cleft(%5Crho%3D%5Cfrac%7Bm%7D%7BV%7D%5Cright)%3D%5Cfrac%7B0%7B%2C%7D25%5Crho%7D%7BM%7D%3D%5Cfrac%7B%5Cleft(910%5Cfrac%7Bg%7D%7Bl%7D%5Ccdot0%7B%2C%7D25%5Cright)mol%7D%7B%5Cleft(14%7B%2C%7D01%2B1%7B%2C%7D008%5Ccdot3%5Cright)%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D13%7B%2C%7D355...%5Capprox13%5Cfrac%7Bmol%7D%7Bdm%5E3%7D)
b)
S.37 1-25
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
m= Massa (g)
M= Moolimassa (g/mol)
S.37 1-23
a)


%3D0%7B%2C%7D10mol)
%3D0%7B%2C%7D14%5Cfrac%7Bmol%7D%7Bl%7D)
%3D%5Cfrac%7Bn%7D%7Bc%7D%3D%5Cfrac%7B0%7B%2C%7D10mol%7D%7B0%7B%2C%7D14%5Cfrac%7Bmol%7D%7Bl%7D%7D%3D0%7B%2C%7D7142...%5Capprox0%7B%2C%7D71l%3D710ml)
b)
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D1%7B%2C%7D0mg%3D0%7B%2C%7D001g)
%3D%5Cleft(22%7B%2C%7D99%2B35%7B%2C%7D45%5Cright)%5Cfrac%7Bg%7D%7Bmol%7D%3D58%7B%2C%7D44%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B0%7B%2C%7D001g%7D%7B58%7B%2C%7D44%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D1%7B%2C%7D711%5Ccdot10%5E%7B-5%7Dmol)

%3D0%7B%2C%7D14%5Cfrac%7Bmol%7D%7Bl%7D)
%3D1%7B%2C%7D711%5Ccdot10%5E%7B-5%7Dmol)

%3D%5Cfrac%7Bn%7D%7Bc%7D%3D%5Cfrac%7B1%7B%2C%7D711%5Ccdot10%5E%7B-5%7Dmol%7D%7B0%7B%2C%7D14%5Cfrac%7Bmol%7D%7Bl%7D%7D%3D1%7B%2C%7D222%5Ccdot10%5E%7B-4%7D%5Capprox0%7B%2C%7D12%5C%20ml)
c)
%3D0%7B%2C%7D14%5Cfrac%7Bmol%7D%7Bl%7D%5Ccdot22%7B%2C%7D99%5Cfrac%7Bg%7D%7Bmol%7D%3D3%7B%2C%7D2186%5Capprox3%7B%2C%7D2%5Cfrac%7Bg%7D%7Bl%7D)
d)

%3D0%7B%2C%7D14%5Cfrac%7Bmol%7D%7Bl%7D%3A2%3D0%7B%2C%7D07mol)
 n= Ainemäärä (mol)
n= Ainemäärä (mol)
 =Avogadron vakio
=Avogadron vakio  (kpl/mol tai 1/mol)
(kpl/mol tai 1/mol)
%3D0%7B%2C%7D07mol)

%3D6%7B%2C%7D022%5Ccdot10%5E%7B23%7D%5Ccdot0%7B%2C%7D07mol%3D4%7B%2C%7D2154%5Ccdot10%5E%7B22%7D%5Capprox4%7B%2C%7D2%5Ccdot10%5E%7B22%7Dkpl)
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
m= Massa (g)
M= Moolimassa (g/mol)
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
c)
d)
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
N= Hiukkasten lukumäärä
S.37 1-21
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
S.37 1-20
a)

%3D3%7B%2C%7D0mol)
%3D2%7B%2C%7D0l)
%3D%5Cfrac%7Bn%7D%7BV%7D%3D%5Cfrac%7B3%7B%2C%7D0mol%7D%7B2%7B%2C%7D0l%7D%3D1%7B%2C%7D5%5Cfrac%7Bmol%7D%7Bl%7D)
b)

%3D1%7B%2C%7D1%5Ccdot10%5E%7B-5%7Dmol)
%3D3%7B%2C%7D0ml%3D0%7B%2C%7D003l)
%3D%5Cfrac%7Bn%7D%7BV%7D%3D%5Cfrac%7B1%7B%2C%7D1%5Ccdot10%5E%7B-5%7Dmol%7D%7B0%7B%2C%7D003l%7D%3D3%7B%2C%7D666%5Ccdot10%5E%7B-3%7D%5Cfrac%7Bmol%7D%7Bl%7D%5Capprox3%7B%2C%7D7%5Cfrac%7Bmmol%7D%7Bl%7D)
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
b)
c= Konsentraatio (mol/l tai mol/dm3)
n= Aineemäärä (mol)
n= Aineemäärä (mol)
V= Tilavuus (l tai dm3)
S.30 1-18
Hyönteismyrkkpullon etiketti ilmaisee, että se sisältää 0,10 massaprosenttia myrkkyä, jonka molekyylikaava on C12H11NO2. Kuinka monta myrkkymolekyyliä on 200ml:n pullossa, jos liuoksen tiheys on 1,0g/ml?
)
 n= Aine määrä (mol)
Kyseessä oleva myrkky on Karbaryyli
n= Aine määrä (mol)
Kyseessä oleva myrkky on Karbaryyli
%3D20ml%5Ccdot1%7B%2C%7D0%5Cfrac%7Bg%7D%7Bml%7D%3D20g)
%3D201%7B%2C%7D221%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B20g%7D%7B201%7B%2C%7D221%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D0%7B%2C%7D09939...%5Capprox0%7B%2C%7D1mol)

%3D0%7B%2C%7D1mol)

%3Dn%5Ccdot%20N_A%3D0%7B%2C%7D1mol%5Ccdot6%7B%2C%7D022%5Ccdot10%5E%7B23%7D%3D6%7B%2C%7D022%5Ccdot10%5E%7B22%7D%5Capprox6%7B%2C%7D0%5Ccdot10%5E%7B22%7D)
m= Massa (g)
M= Moolimassa (g/mol)
S.29 1-16
Erästä alkuainetta X on 0,125 moolia. Tämän ainemäärän massa on 6,98 gramma. Mistä alkuaineesta on kyse?
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D0%7B%2C%7D125mol)
%3D6%7B%2C%7D98g)
%3D%5Cfrac%7Bm%7D%7Bn%7D%3D%5Cfrac%7B6%7B%2C%7D98g%7D%7B0%7B%2C%7D125mol%7D%3D55%7B%2C%7D84%5Cfrac%7Bg%7D%7Bmol%7D)

m= Massa (g)
M= Moolimassa (g/mol)
S.29 1-12
Ratkaise, mikä massa on
a) 2,0 moolilla alumiinia.
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D2%7B%2C%7D0mol)
%3D26%7B%2C%7D98%5Cfrac%7Bg%7D%7Bmol%7D)
%3Dn%5Ccdot%20M%3D2%7B%2C%7D0mol%5Ccdot26%7B%2C%7D98%5Cfrac%7Bg%7D%7Bmol%7D%3D53%7B%2C%7D96%5Capprox54g)
b) 50 moolilla happikaasua.
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D50mol)
%3D16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot2%3D32%5Cfrac%7Bg%7D%7Bmol%7D)
%3Dn%5Ccdot%20M%3D50mol%5Ccdot32%5Cfrac%7Bg%7D%7Bmol%7D%3D1600g%3D1%7B%2C%7D6kg)
c) 0,20 moolilla natriumsulfaattia (Na2SO4)
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D0%7B%2C%7D20mol)
%3D22%7B%2C%7D99%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot2%2B32%7B%2C%7D07%5Cfrac%7Bg%7D%7Bmol%7D%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot4%3D142%7B%2C%7D05%5Cfrac%7Bg%7D%7Bmol%7D)
%3Dn%5Ccdot%20M%3D0%7B%2C%7D20mol%5Ccdot142%7B%2C%7D05%5Cfrac%7Bg%7D%7Bmol%7D%3D28%7B%2C%7D41g%5Capprox28g)
d) 0,65 millimoolilla ammoniumkloridia (NH4Cl). Anna vastaus milligrammoina.
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D0%7B%2C%7D65mmol%3D0%7B%2C%7D00065ml)
%3D14%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot4%2B35%7B%2C%7D45%5Cfrac%7Bg%7D%7Bmol%7D%3D53%7B%2C%7D492%5Cfrac%7Bg%7D%7Bmol%7D)
%3Dn%5Ccdot%20M%3D0%7B%2C%7D00065mol%5Ccdot53%7B%2C%7D492%5Cfrac%7Bg%7D%7Bmol%7D%3D0%7B%2C%7D0347...%5Capprox0%7B%2C%7D035g%3D35mg) e) 2,5*10-9 moolilla A-vitamiinia (C20H30O). Anna vastaus mikrogrammoina.
e) 2,5*10-9 moolilla A-vitamiinia (C20H30O). Anna vastaus mikrogrammoina.
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D2%7B%2C%7D5%5Ccdot10%5E%7B-9%7Dmol)
%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot20%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot30%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%3D286%7B%2C%7D44%5Cfrac%7Bg%7D%7Bmol%7D)
%3Dn%5Ccdot%20M%3D2%7B%2C%7D5%5Ccdot10%5E%7B-9%7Dmol%5Ccdot286%7B%2C%7D44%5Cfrac%7Bg%7D%7Bmol%7D%3D7%7B%2C%7D161%5Ccdot10%5E%7B-7%7D%5Capprox0%7B%2C%7D72%5Ccdot10%5E%7B-6%7Dg%3D0%7B%2C%7D72%C2%B5g)
f) 6,4 pikomoolilla estradiolia (C18H23O2). Anna vastaus nanogrammoina.
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D6%7B%2C%7D4%5Ccdot10%5E%7B-12%7Dmol)
%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot18%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot23%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot2%3D271%7B%2C%7D364%5Cfrac%7Bg%7D%7Bmol%7D)
%3Dn%5Ccdot%20M%3D6%7B%2C%7D4%5Ccdot10%5E%7B-12%7Dmol%5Ccdot271%7B%2C%7D364%5Cfrac%7Bg%7D%7Bmol%7D%3D1%7B%2C%7D737%5Ccdot10%5E%7B-9%7D%5Capprox1%7B%2C%7D7%5Ccdot10%5E%7B-9%7Dg%3D1%7B%2C%7D7ng)
g) 3,0*10-4 moolilla klorofyllia (C51H72O4N4Mg). Anna vastaus milligrammoina.
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D3%7B%2C%7D0%5Ccdot10%5E%7B-4%7Dmol)
%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot51%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot72%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot4%2B14%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot4%2B24%7B%2C%7D31%5Cfrac%7Bg%7D%7Bmol%7D%3D829%7B%2C%7D436%5Cfrac%7Bg%7D%7Bmol%7D)
%3Dn%5Ccdot%20M%3D3%7B%2C%7D0%5Ccdot10%5E%7B-4%7Dmol%5Ccdot829%7B%2C%7D436%5Cfrac%7Bg%7D%7Bmol%7D%3D0%7B%2C%7D248...%5Capprox0%7B%2C%7D25g%3D250mg)
a) 2,0 moolilla alumiinia.
m= Massa (g)
M= Moolimassa (g/mol)
b) 50 moolilla happikaasua.
m= Massa (g)
M= Moolimassa (g/mol)
c) 0,20 moolilla natriumsulfaattia (Na2SO4)
m= Massa (g)
M= Moolimassa (g/mol)
d) 0,65 millimoolilla ammoniumkloridia (NH4Cl). Anna vastaus milligrammoina.
m= Massa (g)
M= Moolimassa (g/mol)
m= Massa (g)
M= Moolimassa (g/mol)
f) 6,4 pikomoolilla estradiolia (C18H23O2). Anna vastaus nanogrammoina.
m= Massa (g)
M= Moolimassa (g/mol)
g) 3,0*10-4 moolilla klorofyllia (C51H72O4N4Mg). Anna vastaus milligrammoina.
m= Massa (g)
M= Moolimassa (g/mol)
S.29 1-11
Mikä on ainemäärä
a) Kultaa on 35 milligrammassa?
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D35mg%3D0%7B%2C%7D035g)
%3D196%7B%2C%7D97%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B0%7B%2C%7D035g%7D%7B196%7B%2C%7D97%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D1%7B%2C%7D776%5Ccdot10%5E%7B-4%7D%5Capprox1%7B%2C%7D8%5Ccdot10%5E%7B-4%7Dmol)
b) Natriumnitraattia (NaNO3) on 2,50 gramassa?
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D2%7B%2C%7D50g)
%3D22%7B%2C%7D99%5Cfrac%7Bg%7D%7Bmol%7D%2B14%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot3%3D85%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B2%7B%2C%7D5g%7D%7B85%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D0%7B%2C%7D02941...%5Capprox0%7B%2C%7D0294mol)
c) Kolesterolia (C27H46O) on 4,5 litrassa verta, jos sitä on 0,294 grammaa 1,0 litrassa verta?
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D0%7B%2C%7D294g)
%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot27%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot46%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%3D386%7B%2C%7D638%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B0%7B%2C%7D294g%7D%7B386%7B%2C%7D638%5Cfrac%7Bg%7D%7Bmol%7D%7D%5Ccdot4%7B%2C%7D5%3D3%7B%2C%7D421%5Ccdot10%5E%7B-3%7D%5Capprox3%7B%2C%7D4%5Ccdot10%5E%7B-3%7Dmol)
d) Vesimolekyylejä on 1,5dl:ssa huoneelämpöistä vettä (eden tiheys on 1,0g/ml)?
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D1%7B%2C%7D5dl%3D150ml%3D150%5Ccdot1%5Cfrac%7Bg%7D%7Bml%7D%3D150g)
%3D1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot2%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%3D18%7B%2C%7D016%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B150g%7D%7B18%7B%2C%7D016%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D8%7B%2C%7D325...%5Capprox8%7B%2C%7D3mol)
e) C-vitamiinia on 1,0 litran tuoremehutölkissä, jos 1,0dl mehua sisältää 35mg C-vitamiinia (C6H8O6)?
 n= Aine määrä (mol)
n= Aine määrä (mol)
%3D35mg%3D0%7B%2C%7D035g%5Cleft(100g%5Cleft(dl%5Cright)%5Cright))

%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot6%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot8%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot6%3D176%7B%2C%7D124%5Cfrac%7Bg%7D%7Bmol%7D)
%3D%5Cfrac%7Bm%7D%7BM%7D%3D%5Cfrac%7B0%7B%2C%7D035g%7D%7B176%7B%2C%7D124%5Cfrac%7Bg%7D%7Bmol%7D%7D%3A100%5Ccdot1000%3D0%7B%2C%7D001987...%5Capprox0%7B%2C%7D0020mol)
a) Kultaa on 35 milligrammassa?
m= Massa (g)
M= Moolimassa (g/mol)
b) Natriumnitraattia (NaNO3) on 2,50 gramassa?
m= Massa (g)
M= Moolimassa (g/mol)
c) Kolesterolia (C27H46O) on 4,5 litrassa verta, jos sitä on 0,294 grammaa 1,0 litrassa verta?
m= Massa (g)
M= Moolimassa (g/mol)
d) Vesimolekyylejä on 1,5dl:ssa huoneelämpöistä vettä (eden tiheys on 1,0g/ml)?
m= Massa (g)
M= Moolimassa (g/mol)
e) C-vitamiinia on 1,0 litran tuoremehutölkissä, jos 1,0dl mehua sisältää 35mg C-vitamiinia (C6H8O6)?
m= Massa (g)
M= Moolimassa (g/mol)
S.29 1-10
Laske seuraavien yhdisteiden moolimassat.
a) Etanoli C2H6O
%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot2%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot6%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%3D46%7B%2C%7D068%5Cfrac%7Bg%7D%7Bmol%7D)
b) Ksylitoli C5H12O5
%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot5%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot12%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot5%3D152%7B%2C%7D146%5Cfrac%7Bg%7D%7Bmol%7D)
c) A-vitamiini C20H30O
%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot20%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot30%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%3D286%7B%2C%7D44%5Cfrac%7Bg%7D%7Bmol%7D)
d) Kofeiini C8H10N4O2
%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot8%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot10%2B14%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot4%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot2%3D194%7B%2C%7D20%5Cfrac%7Bg%7D%7Bmol%7D)
e) Aspartaami C14H18N2O5
%3D12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot14%2B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot18%2B14%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot2%2B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%5Ccdot5%3D294%7B%2C%7D304%5Cfrac%7Bg%7D%7Bmol%7D)
a) Etanoli C2H6O
b) Ksylitoli C5H12O5
c) A-vitamiini C20H30O
d) Kofeiini C8H10N4O2
e) Aspartaami C14H18N2O5
S.28 1-9
Näyte glukoosia  sisältää 0,100 moolia glukoosia.
sisältää 0,100 moolia glukoosia.
a) Kuinka monta glukoosimolekyyliä näyte sisältää?



b) Kuinka monta moolia vetyatomeja näyte sisältää?
%3D12%5Ccdot0%7B%2C%7D100mol%3D1%7B%2C%7D2mol)
c) Kuinka monta hiiliatomia näyte sisältää?
%3D6%7B%2C%7D022%5Ccdot10%5E%7B22%7D%5Ccdot6%3D3%7B%2C%7D6132%5Ccdot10%5E%7B23%7D)
a) Kuinka monta glukoosimolekyyliä näyte sisältää?
b) Kuinka monta moolia vetyatomeja näyte sisältää?
c) Kuinka monta hiiliatomia näyte sisältää?
S.28 1-8
Ratkaise atomien luku määrä, kun
a) n( )=0,50 mol
)=0,50 mol



b) n( )=40 mmol
)=40 mmol




c) n( )= 4,0 mol
)= 4,0 mol



a) n(
b) n(
c) n(
S.20 1-4
a) 14
b) 28, 29, 30
c) 14, 15, 16
d)


b) 28, 29, 30
c) 14, 15, 16
d)