7 Aine ja reaktio
Toinen kemian koe - syksy
Puhtaat aineet ja niiden seokset
Johdanto
Puhdas juomavesi ja puhdas ruoka ovat turvallisia, koska niissä ei ole myrkyllisiä ainesosia eikä tavallisesti pahaa makuakaan. Kemiallisesti ne eivät kuitenkaan ole puhtaita, koska ne ovat useiden aineiden seoksia. Kemiallisesti puhdas vesi on jopa haitallista ihmiselle, koska siinä ei ole lainkaan suoloja. Puhtaita aineita meillä on kemian varastossa ja malleissa, jotka auttavat oppimaan kemiaa. Luonnossa puhtaat aineet ovat harvinaisia mutta seokset yleisiä.
Luokittelu ja esimerkit
| Puhdas aine sisältää vain yhdenlaisia rakenneosia |
|
| Alkuaine Kaikki rakenneosat ovat saman alkuaineen atomeita tai alkuainemolekyylejä.
|
Yhdiste Kaikki rakenneosat ovat keskenään samanlaisia, molekyylejä tai suolayhdisteitä. Kaava kertoo alkuaineiden suhteet rakenneosassa.
|
| Seos sisältää erilaisia rakenneosia Sillä ole yksiselitteistä kaavaa, koska seossuhteet voivat vaihdella |
|
| Homogeeninen seos eli tasakoosteinen seos Sekoittuu täysin pienimpinä rakenneosinaan.
|
Heterogeeninen seos eli sekakoosteinen seos ei sekoitu tasaiseksi. Rakenneosien kuten kiteiden tai pisaroiden koko vaihtelee.
|
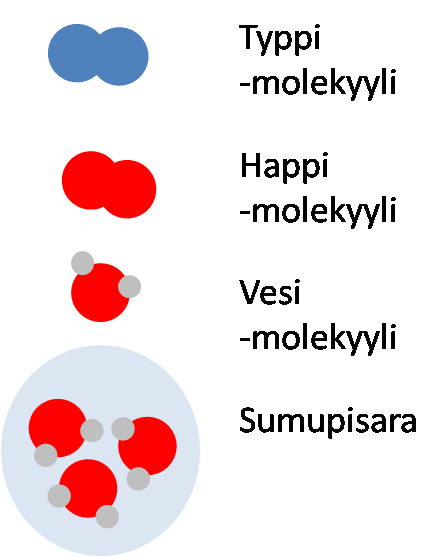
Kirkkas ilma ja sumuinen ilma
| Mallien selitteet | Kirkas ilma on homogeeninen seos | Sumuinen ilma on heterogeeninen seos |
 |
 |
 |
Liuos ja liukeneminen - muistiinpanot
Liuos muodostuu liuottimesta ja liuenneesta aineesta
- On tasakoosteinen seos
- Yleensä neste
- Liuotin on yleensä neste, jota liuokseessa on eniten
- Liuennut aine on sekoittunut niin tasaisesti, että jokainen rakenneosa liikkuu vapaasti
- Liuennut aine voi puhtaana olla kiinteää, nestettä tai kaasua
- Liuenneita aineita voi olla useampia kuin yksi
- Liuos on yleensä valoa läpäisevä ja joko kirkas tai värillinen
- Jos seos on samea, se ei ole liuos.
- Usein sameuden aiheuttaa jokin sakka, joka ei liukene liuottimeen
Ⓔ Liuoksia: merivesi, laimennettu suolahappo
Ⓔ Ei liuoksia: velli, maito
Liuoksen pitoisuus eli väkevyys
- Tarkoittaa liuenneen aineen osuutta liuoksessa.
- Laimeassa liuoksessa pitoisuus on matala ja
- väkevässä korkea.
- Jos liuoksessa on niin paljon liuennutta ainetta, että enempää ei voi liueta, liuos on kylläinen.
Liukoisuus
- Suure, joka kertoo kuinka paljon ainetta voi liueta.
- Toisin sanoen kylläisen liuoksen pitoisuuden.
- Liukoisuus riippuu
- liuottimesta
- liuotettavasta aineesta
- lämpötilasta
Ⓔ Kuinka monta grammaa sokeria voi liueta desilitraan vettä huoneenlämpötilassa (n. 20 °C)
Voidaan tutkia kokeellisesti tai etsiä tieto internetistä tai taulukkokirjoista
Liukenemisnopeus
Liukoisuuden tutkiminen on joskus hidasta, koska liuottimeen lisätty aine ei liukene saman tien.
Liukenemista voidaan kuitenkin nopeuttaa ja siihen vaikuttavat
- Liukoisuus (Liuotin ja liuotettava aine)
- Liuotettavan aineen hienojakoisuus
- Lämpötila
- Sekoittaminen
Huom: Liuoksen valmistus - oppilastyöt!
Olethan tarkkana. Koetilanteessa saatetaan kysyä liuoksen valmistamisesta käytännössä.
Erotusmenetelmät - muistiinpanot
Alustus:
Liuoskappaleessa tehtiin sekoitus ja käsiteltiin liukenemisnopeutta ja liukoisuutta (kaksi eri asiaa, kertaa tarvittaessa).
Nyt pohditaan, miten aineet saadaan taas eroon toisistaan.
Erotusmenetelmiä tarvitaan
- Aineiden tutkimiseen
Ⓔ verikokeet, koronavirus-testi, dopingnäytteiden tutkimus, maaperätutkimukset - Puhdistamiseen
Ⓔ juomavesi ja jätevesi, pakokaasut - Tuotteiden valmistamiseen
Ⓔ merisuolan valmistus, bensiinin ja bitumin erottaminen raakaöljystä,
kapsaisiinin ekstraktointi chilistä
Periaate (lisätietoa)
Erotusmenetelmissä puhutaan usein faaseista. Faasi tarkoittaa olomuotoa tai olomuotoaluetta.
Usein menetelmässä on liikkuva faasi (jotain liikkuu) ja paikallaan pysyvä faasi (jotain pysyy paikallaan)
Aineen erottuminen seoksesta perustuu faasimuutoksiin. Eroteltava aine joko:
- jää paikallaan pysyvään (kiinteään) faasiin tai
- siirtyy liikkuvaan (nestemäiseen) faasiin
Menetelmät (alleviivatut kirjassa):
- Uuttaminen
Erotettaa kiinteästä aineesta liukenevan osan liuottimen joukkoon.
Ⓔ Teen haudutus, aromia ja väriä liukenee veteen mutta lehti ei. - Suodattaminen
Erottaa nesteen joukosta karkean kiintoaineksen pois.
Toimii epähomogeeniselle seokselle. Liuos menee läpi.
Ⓔ Kahvin tai teen suodatus
Ⓔ Juomaveden suotautuminen harjun läpi
- Aktiivihiilisuodatus
- Hiilipöly sitoo itseensä joitakin liukoisia aineita
- Voidaan lisätä nesteeseen ennen suodatusta
- Lääkehiili sitoo vatsassa myrkkyjä ja estää niiden pääsyn limakalvojen läpi
- Kaasunaamarin ilmasuodattimessa
- Kalvosuodatus
- Kalvo eli membraani, joka muistuttaa solukalvoa
- Suodatus vaatii suuren paineen eli tarvitsee pumppausta
- Erottaa liuoksesta puhdasta liuotinta, kun liuosta paineistetaan kalvoa vasten.
Ⓔ Mikkelin uusi jätevedenpuhdistamo
- Aktiivihiilisuodatus
- Haihduttaminen
Erottaa liuokseen liuenneen aineen. Neste eli liuotin haihtuu ilmaan.- Odottamalla, auringon valossa tai keittämällä haihdutusmaljassa
Ⓔ CuSO4 eli kuparisulfaatti jää petrimaljan pohjalle (petrimaljat kaapissa)
Ⓔ Natriumkloridin (ruokasuola) erottaminen merivedestä
- Odottamalla, auringon valossa tai keittämällä haihdutusmaljassa
- Tislaaminen
- Erottaa liuoksesta liuottimen
- Keitetään liuosta, höyry kerätään talteen ja annetaan tiivistyä takaisin nesteeksi jäähdyttimessä.
Ⓔ veden tislaaminen eroon teestä
- Keitetään liuosta, höyry kerätään talteen ja annetaan tiivistyä takaisin nesteeksi jäähdyttimessä.
- Erottaa tietyn liuottimen liuoksesta
- Eri nesteet höyrystyvät eri lämpötiloissa.
- Ensin höyrystyy alhaisimman kiehumispisteen neste.
Ⓔ vesi 100 °C ja etanoli 78 °C
Etanoli höyrystyy ensin. Näin saadaan väkeväö alkoholia.
- Erottaa liuoksesta liuottimen
- Linkous
Lingotaan pyörivällä liikkeellä koeputkia, jolloin raskaammat aineet painuvat pohjalle.
Erotinta kutsutaan sentrifugiksi.
Esim. Veriplasma ja punasolut erottuvat toisistaan.Voidaan myös yhdistää siivilöintiin kuten pyykin linkouksessa. Vesi poistuu siivilän läpi. - Kromatografia - (lisätietoa)
Erottaa liuenneet aineet toisistaan liukoisuuteen perustuen
Esim paperikromatografia. Tussissa on liuenneina väriaineita, täplä paperille.
Väriaineet liikkuvat eri nopeuksilla ajoaineen (liikkuva faasi) mukana tai jäävät paikoilleen.
Ajoaine liikkuu paperia (pysyvä faasi) pitkin kapillaarisesti.
Väriaineet erottuvat erillisinä rintamina tai jäävät paikoilleen. - Saostus (lisätietoa)
Liuennut aine erottuu nesteestä sakkana.
Kahden erilaisen liuoksen sekoittuessa osa liuenneista aineista usein saostuu.
Esim metallien talteenotossa - Flokkulaatio (lisätietoa)
Orgaanisen eli eloperäisen aineen kerääntyminen hiutaleiksi jäteveden puhdistuksen aikana.
Kuoritaan altaan pinnalta.
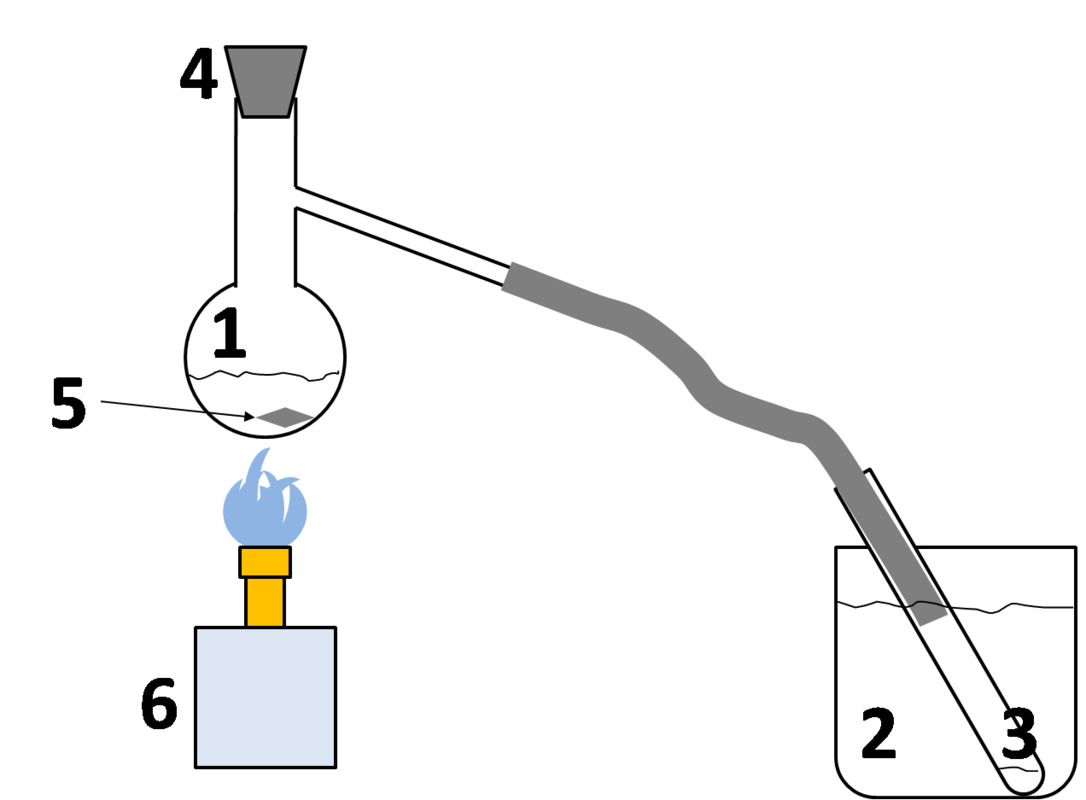
Tislauslaitteisto
- Tislauskolvi
Täällä on eroteltava seos, jonka helpoimmin höyrystyvä aine kiehuu ensin. - Jäähdytin
Laskee kaasun lämpötilaa, jolloin se tiivistyy takaisin nesteeksi - Keräysastia
Tänne kerääntyy tislauksessa erottunut aine eli tisle. - Korkki
Estää höyrystynyttä ainetta karkaamasta - Kiehumakivi
Rauhoittaa kuplimista keittämisen aikana - Kaasupoltin
Käytä sinistä liekkiä, joka ei nokea.
- Lisäksi tislauslaitteistoa varten tarvitaan statiivitanko, kaksoispuristin ja koura kiinnitystä varten sekä kolmijalka ja kuumennusverkko hillitsemään nokeentumista ja ylikuumenemista.
- Korkkiin on mahdollista lisätä lämpömittari. Sitä tarvitaan erityisesti silloin, kun erotetaan toisistaan nesteitä, joilla on eri kiehumispiste.
- Mestaritislaajan keräysastiana toimiva koeputki täyttyy nopeasti ja tisle on kirkasta.
- Silloin seosta ei saa joutua yhtään kolvin haaraputkeen
- Kaasupoltinta käytetään sopivalla teholla ja jäähdytin on riittävän kylmä
- Seoksesta erottuu ensimmäisenä se liuotin, jonka kiehumispiste on alin
Kemiallinen reaktio - muistiinpanot
Kemiallinen reaktio, perusteet
- Tapahtuma, jossa
- aineet reagoivat keskenään kemiallisesti ja muodostuu uusia yhdisteitä
- tai jokin yhdiste hajoaa alkuaineiksi
- Yuntomerkkinä valoa, ääntä, kuplia, värejä, savua, uusia aineita
- Kuvataan reaktioyhtälöllä, jonka kulkusuuntaa esittää reaktionuoli:
Lähtöaineet → reaktiotuotteet - Atomit eivät reaktiossa muutu, joten jokaista alkuainetta on yhtä paljon lähtöaineena ja reaktiotuotteena.
Ⓔ Ruokasuolan muodostuminen
Na + Cl → NaCl
natrium + kloori → natriumkloridi
Ⓔ Vetyperoksidin hajoaminen - DEMO: Elefantin hammastahna
Mittalasiin loraus vetyperoksidia ja tilkka fairyä. Sekoitetaan ja lisätään ripaus mangaanidioksidia.
Havainnot: Muodostuu runsaasti vaahtoa!
Pohdinta: Mitä kuplien sisällä oikein on?
Reaktioyhtälö: 2 H2O2 → 2 H2O + O2
vetyperoksidi → vesi + happi
Huom: Vesi H2O on vaaraton janonsammuttaja,
vetyperoksidi H2O2 puolestaan on hyvin reaktiivinen aine, joka on sekä hapettava että myrkyllinen.
Tietoa:
Kuplat täyttää reaktiossa muodostuva happikaasu. Se vie paljon enemmän tilaa kuin nestemäinen vesi. Fairyä on mukana, jotta kaasu jäisi kuplien sisään. mangaanidioksidi toimii katalyyttina eli se nopeuttaa vetyperoksidin hajoamista. Vetyperoksidi hajoaa hitaasti myös itsestään. Se säilytetään jääkaapissa, jotta hajoaminen olisi mahdollisimman hidasta.
Reaktionopeus
- Reaktio voi olla rauhallinen eli hidas Ⓔ raudan ruostuminen
- Tai kiivas eli nopea Ⓔ tähtisadetikun palaminen
- Reaktiota nopeuttaa
- Lähtöaineiden valinta
- Väkevyys eli pitoisuus
- Hienojakoisuus
- Hyvä sekoittuminen
- Korkea lämpötila
- Katalyytin käyttö
Katalyytti on aine, joka lisää reaktionopeutta mutta ei itse reagoi.
Katalyytti ei siis kulu reaktiossa.
Reaktion hidastaminen
Katalyytin vastakohta on inhibiittori. Sen tehtävä on hidastaa kemiallista reaktiota. Omenasalaattiin voidaan lisätä etikkaa, jotta omenaviipaleiden tummuminen hidastuisi. Etikka on inhibiittori, jonka tehtävä on toimia hapettumisenestoaineena. On hyödyllistä hidastaa erilaisia pilaantumisreaktioita. Siksi moneen valmisruokaan lisätään säilöntäaineita ja suojataan ruoka reaktiota nopeuttavilta olosuhteilta.
Mielenkiintoisia reaktioita
Reaktioyhtälön tasapainottaminen
- Yhdisteen kemiallisessa kaavassa esiintyvä alaindeksi ilmaisee atomien lukumäärää.
Ⓔ Vesimolekyylissä H2O alaindeksi 2 kertoo että vetyatomeita (H) on kaksi kappaletta - Yhdisteen kaavan edessä oleva iso numero ilmaisee molekyylien lukumäärää.
Ⓔ 2 H2O tarkoittaa kahta vesimolekyyliä - Reaktioyhtälön tasapainotus on sitä, että lisätään molekyylien lukumäärää sopivasti, että jokaista alkuainetta on yhtä paljon reaktioyhtälön molemmilla puolilla eli lähtöaineissa ja reaktiotuotteissa.
Harjoitellaan
Tasapainotetaan reaktioyhtälö, jossa vetyperoksidi hajoaa vedeksi ja hapeksi.
Mitkä ovat puuttuvat numerot?
___ H₂O₂ → ____ H₂O + ____ O₂
Ratkaisu:

Tasapainotetaan reaktioyhtälö, jossa magnesium reagoi suolahapon kanssa muodostaen magnesiumkloridia ja vetykaasua.
Mitkä ovat puuttuvat numerot?
___ Mg + ___ HCl → ___ MgCl₂ + ___ H₂
Palaminen - muistiinpanot
Palaminen
- Kemiallinen reaktio, jossa palava aine reagoi hapen kanssa
- Lähtöaineita ovat siis palava aine ja happi
- Reaktiotuotteena hapen yhdisteitä eli oksideja
C + O2 → CO2 eli
hiili + happimolekyyli → hiilidioksidi
Ⓔ Hiilen palaminen, kun happea on tarjolla niukasti
C + O → CO eli *
hiili + happi → hiilimonoksidi
* Huom: Ilmassa happi esiintyy happimolekyyleinä O2
Oikein tasapainotettu reaktioyhtälö on tässä:
2 C + O2 → 2 CO
Huom: Hiilidioksidi voi väsyttää ihmistä. Hiilimonoksidi eli häkä sen sijaan on tappavaa.
Palamisen kolmio
Palamisella on kolme vaatimusta ja kolme sammutustapaa, jolla palamisen edellytys poistetaan.
Taulukot
- Syttymispiste on lämpötila, jossa palava aine syttyy "itsestään", jos happea on saatavilla
- Leimahduspiste on lämpötila, jossa palava aine höyrystyy vaarallisesti ja voi syttyä kipinästä tai lähellä olevasta tulitikusta