4. Metallien jalousjärjestys
Johdanto
Miksi rauta ruostuu ilman hapen ja kosteuden vaikutuksesta, mutta kulta ei? Miksi magnesium reagoi niin kiivaasti laimean suolahapon kanssa, mutta kupari ei? Tai miksi natriumin reaktio veden kanssa on niin kiivas, mutta raudan paljon hitaampi? Metallien reaktiivisuuksissa on siis suuria eroja.

Tarkastellaan näiden erojen syitä tarkemmin. Metallien reaktiokykyä voidaan vertailla neljällä eri reaktiolla:

Tarkastellaan näiden erojen syitä tarkemmin. Metallien reaktiokykyä voidaan vertailla neljällä eri reaktiolla:
- palaminen eli reaktio hapen kanssa
- reaktio laimean suolahapon kanssa
- reaktio veden kanssa
- reaktio toisen metallin kanssa.
1. Palaminen
Osa metalleista palaa eli yhtyy kemiallisesti happeen. Osa metalleista on palamattomia. Palava metalli, kuten esimerkiksi magnesium Mg, luovuttaa elektroneja happiatomille. Tällöin metalli saa positiivisen plus-merkkisen varauksen ja vastaavasti happi negatiivisen miinus-merkkisen varauksen.
Kaksi alun perin alkuaineena olevaa ainetta ovat muuttuneet ioneiksi. Reaktiossa on muodostunut ionirakenteinen yhdiste, magnesiumoksidi.
[[$ 2\text{Mg}+\text{O}_2 \rightarrow 2\text{MgO} $]]
Sanotaan, että palamisreaktiossa metalli hapettuu ja happi pelkistyy. Yleisesti, kun aine luovuttaa elektroneja se hapettuu, ja kun aine ottaa vastaan elektroneja se pelkistyy.
Kaksi alun perin alkuaineena olevaa ainetta ovat muuttuneet ioneiksi. Reaktiossa on muodostunut ionirakenteinen yhdiste, magnesiumoksidi.
[[$ 2\text{Mg}+\text{O}_2 \rightarrow 2\text{MgO} $]]
Sanotaan, että palamisreaktiossa metalli hapettuu ja happi pelkistyy. Yleisesti, kun aine luovuttaa elektroneja se hapettuu, ja kun aine ottaa vastaan elektroneja se pelkistyy.
2. Reaktio laimean suolahapon kanssa
Aivan kuten hapen kanssa, vain osa metalleista reagoi laimean suolahapon kanssa muodostaen vetyä.
[[$ \text{Mg} + 2\text{H}^+ \rightarrow \text{Mg}^{2+} + \text{H}_2 $]]
Jos metalli reagoi suolahapon kanssa, se luovuttaa elektroneja hapon vesiliuokseen tuottamille oksonium-ioneille eli metalli hapettuu ja muuttuu positiiviseksi ioniksi. Oksoniumionit ottavat elektroneja vastaan eli ne pelkistyvät ja hajoavat samalla vetykaasuksi ja vedeksi.
[[$ \text{Mg} + 2\text{H}^+ \rightarrow \text{Mg}^{2+} + \text{H}_2 $]]
Jos metalli reagoi suolahapon kanssa, se luovuttaa elektroneja hapon vesiliuokseen tuottamille oksonium-ioneille eli metalli hapettuu ja muuttuu positiiviseksi ioniksi. Oksoniumionit ottavat elektroneja vastaan eli ne pelkistyvät ja hajoavat samalla vetykaasuksi ja vedeksi.
Esimerkiksi magnesiumin ja vedellä laimennetun suolahapon välinen reaktio on:
[[$
\text{Mg} + 2\text{H}_3\text{O}^+ + 2\text{Cl}^- \rightarrow \text{H}_2
+ \text{Mg}^{2+} + 2\text{Cl}^- + 2\text{H}_2\text{O} $]]
3. Reaktio veden kanssa
Alkalimetallit, kuten esimerkiksi natrium, reagoivat voimakkaasti veden kanssa.
4. Reaktio kahden metallin välillä
Kaksi eri metallia voivat reagoida keskenään, kunhan toinen niistä on alkuainemuodossa (ei varausta) ja toinen positiivisena ionina (varaus + -merkkinen). Esimerkiksi reaktiossa [[$ \text{Fe + Cu}^{2+} \rightarrow \text{Fe}^{2+} + \text{Cu} $]] 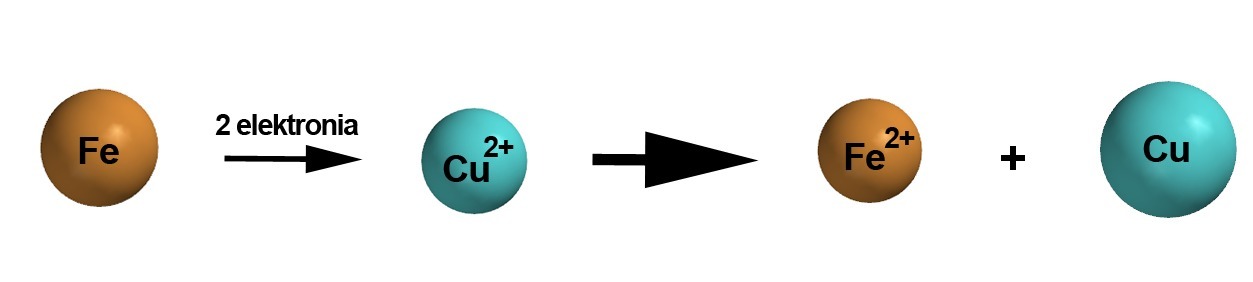 tapahtuu hapettumis-pelkistymisreaktio, jossa roolit vaihtuvat: kupari-ioni ottaa vastaan raudalta kaksi elektronia ja pelkistyy alkuainemuotoon rauta-atomi puolestaan hapettuu ionimuotoon. Syynä on että rauta on "mieluimmin" ionimuodossa, kupari atomeina. Toisinpäin, eli [[$ \text{Fe}^{2+} + \text{Cu} \rightarrow \text{Fe} + \text{Cu}^{2+} $]] , reaktiota ei tapahdu. Aivan vastaavalla tavalla osat vaihtuvat, kun hopeaioneja laitetaan alkuainemuodossaan olevan kuparin sekaan. [[$ \text{Cu + 2 Ag}^{+} \rightarrow \text{Cu}^{2+} + \text{2 Ag} $]]
tapahtuu hapettumis-pelkistymisreaktio, jossa roolit vaihtuvat: kupari-ioni ottaa vastaan raudalta kaksi elektronia ja pelkistyy alkuainemuotoon rauta-atomi puolestaan hapettuu ionimuotoon. Syynä on että rauta on "mieluimmin" ionimuodossa, kupari atomeina. Toisinpäin, eli [[$ \text{Fe}^{2+} + \text{Cu} \rightarrow \text{Fe} + \text{Cu}^{2+} $]] , reaktiota ei tapahdu. Aivan vastaavalla tavalla osat vaihtuvat, kun hopeaioneja laitetaan alkuainemuodossaan olevan kuparin sekaan. [[$ \text{Cu + 2 Ag}^{+} \rightarrow \text{Cu}^{2+} + \text{2 Ag} $]] 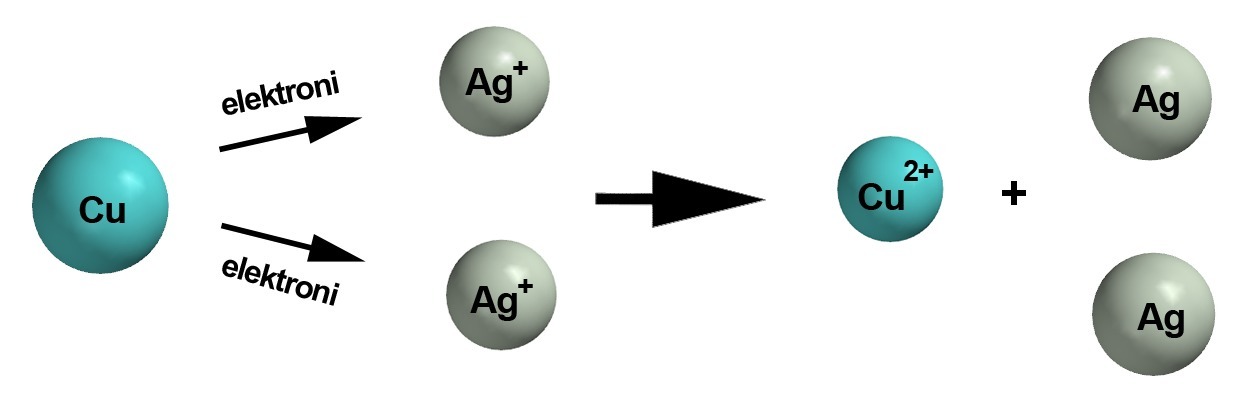

 tapahtuu hapettumis-pelkistymisreaktio, jossa roolit vaihtuvat: kupari-ioni ottaa vastaan raudalta kaksi elektronia ja pelkistyy alkuainemuotoon rauta-atomi puolestaan hapettuu ionimuotoon. Syynä on että rauta on "mieluimmin" ionimuodossa, kupari atomeina. Toisinpäin, eli [[$ \text{Fe}^{2+} + \text{Cu} \rightarrow \text{Fe} + \text{Cu}^{2+} $]] , reaktiota ei tapahdu. Aivan vastaavalla tavalla osat vaihtuvat, kun hopeaioneja laitetaan alkuainemuodossaan olevan kuparin sekaan. [[$ \text{Cu + 2 Ag}^{+} \rightarrow \text{Cu}^{2+} + \text{2 Ag} $]]
tapahtuu hapettumis-pelkistymisreaktio, jossa roolit vaihtuvat: kupari-ioni ottaa vastaan raudalta kaksi elektronia ja pelkistyy alkuainemuotoon rauta-atomi puolestaan hapettuu ionimuotoon. Syynä on että rauta on "mieluimmin" ionimuodossa, kupari atomeina. Toisinpäin, eli [[$ \text{Fe}^{2+} + \text{Cu} \rightarrow \text{Fe} + \text{Cu}^{2+} $]] , reaktiota ei tapahdu. Aivan vastaavalla tavalla osat vaihtuvat, kun hopeaioneja laitetaan alkuainemuodossaan olevan kuparin sekaan. [[$ \text{Cu + 2 Ag}^{+} \rightarrow \text{Cu}^{2+} + \text{2 Ag} $]] 

Johtopäätös
Metallit ovat alkuaineena sitä reaktiokykyisempi, mitä helpommin ne voivat luovuttaa elektronejaan toisille aineille. Reaktiossa metallit siis hapettuvat positiiviseksi ioniksi metalli-ioneiksi. Tämän havainnon perusteella metallit voidaan asettaa järjestykseen. Tätä järjestystä kutsutaan metallien sähkökemialliseksi jännitesarjaksi eli niiden jalousjärjestykseksi. Jännitesarja alkaa epäjaloimmasta ja päättyy jaloimpaan metalliin.
Metallien jännitesarjassa ennen vetyä sijaitsevat metallit ovat epäjaloja ja vedyn jälkeen sijaitsevat jaloja metalleja. Vety toimii “vedenjakajana” vaikka se ei olekaan metalli, koska epäjalon metallin ja hapon välisessä reaktiossa syntyy vetykaasua. Jaloilla metalleilla näin ei tapahdu.

Metallien jännitesarjassa ennen vetyä sijaitsevat metallit ovat epäjaloja ja vedyn jälkeen sijaitsevat jaloja metalleja. Vety toimii “vedenjakajana” vaikka se ei olekaan metalli, koska epäjalon metallin ja hapon välisessä reaktiossa syntyy vetykaasua. Jaloilla metalleilla näin ei tapahdu.

Metalli atomi ja metalli-ioni
Metalliatomi luovuttaa ulkoelektroninsa itseään jalomman metallin ionille eli pelkistää ionit atomiksi. Jalomman metallin ionit pelkistyy atomiksi epäjalomman metallin pinnalle. Samalla epäjalomman metallin atomi hapettuu ioniksi.
Yleisesti voidaan todeta sääntönä:
Kemiallinen reaktio tapahtuu kun epäjalompi metalli laitetaan liuokseen, jossa on jalomman metallin ioneja.
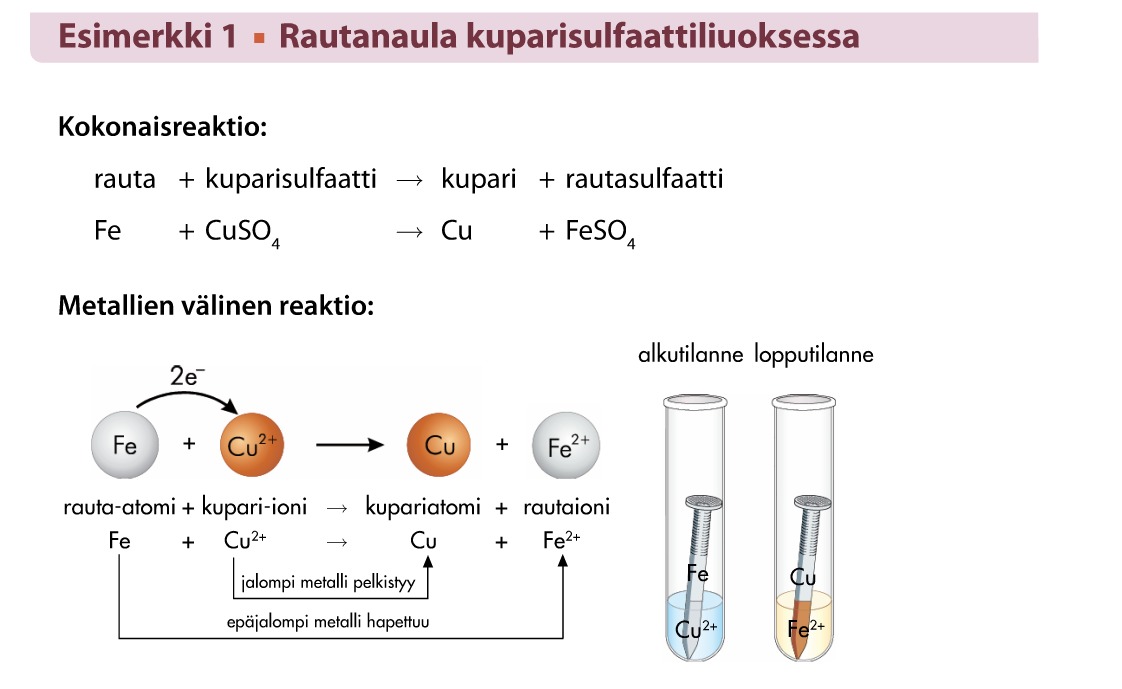
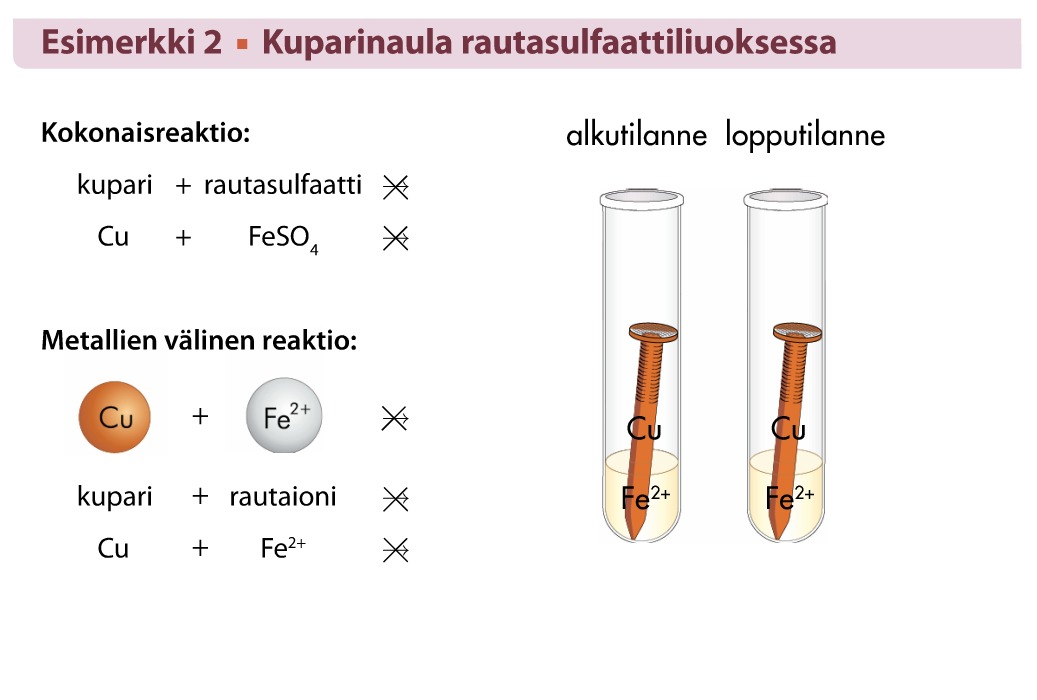
Yleisesti voidaan todeta sääntönä:
Kemiallinen reaktio tapahtuu kun epäjalompi metalli laitetaan liuokseen, jossa on jalomman metallin ioneja.

