Metallernas kemi Åk9
METALLERNAS EGENSKAPER
- Metallatomer har i allmänhet en eller två elektroner i det yttersta skalet.
- Metallernas joner är posivit laddade.
- Metaller leder elektricitet och värme.
- Metaller är sega och formbara, de kan smidas och tänjas.
- Metallerna har hög smältpunkt.
METALLERNAS SPÄNNINGSSERIE
Oxidation
- Ett ämne oxideras då det reagerar med syre och bildar en oxid.
- Ett ämne oxideras då det ger bort elektroner (allmän definition).
- Ett ämne reduceras då det ger bort syre.
- Ett ämne reduceras då det tar emot elektroner (allmän definition).
Exempel på oxidation och reduktion
Oxidation av järn innebär att en järnatom blir till en järnjon genom att ge bort två elektroner.
Fe -> Fe2+ + 2e-
Reduktion av en järn innebär att en järnjon blir till en järnatom genom att ta emot två elektroner.
Fe2+ + 2e- -> Fe
Metallernas spänningsserie:
Li K Ba Ca Na Mg Al Zn Cr Fe Co Ni Sn Pb (H) Cu Hg Pt Ag Au (C)
Exempel på hur man använder metallernas spänningsserie
- Ädla metaller som finns till höger om H regerar inte med syror så att vätgas frigörs. Oädla metaller som finns till vänster om H reagerar med syror så att vätgas frigörs.
- Ju längre till vänster en metall finns i metallernas spänningsserie, desto oädlare är metallen och desto lättare bildar den joner genom oxidation (ger bort elektroner).
- En metall till vänster reducerar alltid joner av en metall till höger.
Metaller är reduktionsmedel (video av Magnus Ehinger)
Förhör
GALVANISKT ELEMENT
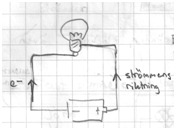
- Lampan lyser om det går en elström i den slutna kretsen.
- För att få en elström behövs en spänning som fås från ett batteri.
- Spänningen finns mellan batteriets positiva pol (+) och en negativa pol (-).
- P.g.a. spänningen rör sig elektroner (e-) från - till + genom kretsen och lampan.
Ett galvaniskt element (batteri) består av:
- två olika metaller
- elektrolyt d.v.s. en vätska som leder elektricitet p.g.a. att den innehåller joner
- den oädlare metallen blir negativa pol och den ädlare positiv pol
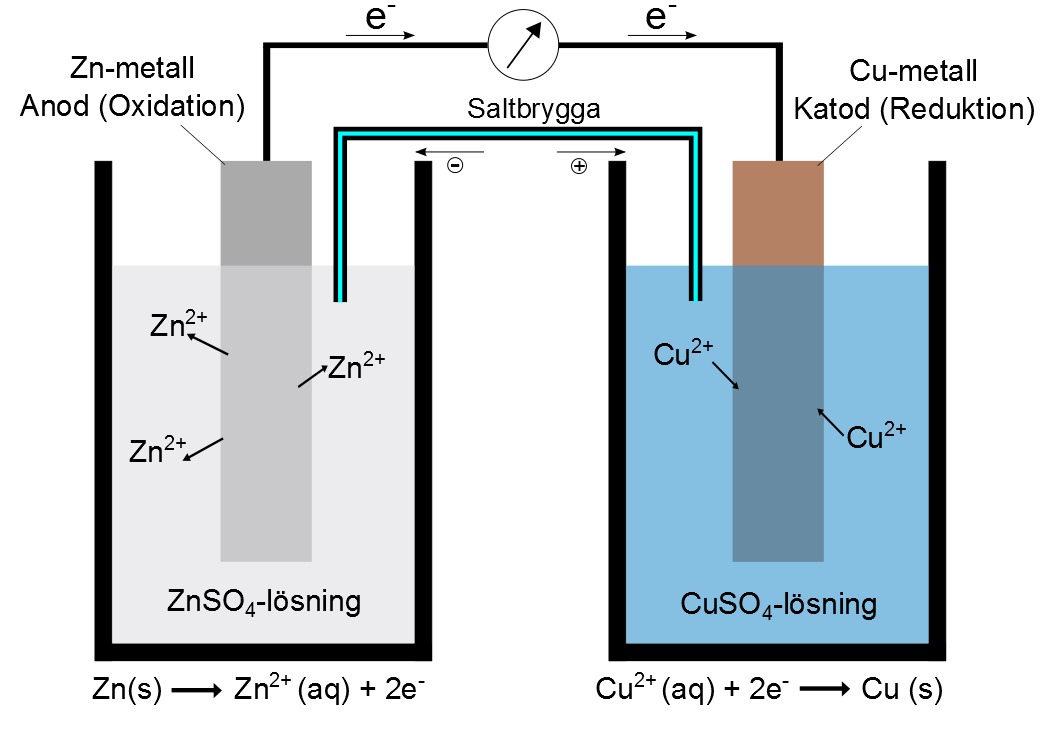
Galvanisk element (video av Magnus Ehinger)
ELEKTROLYS
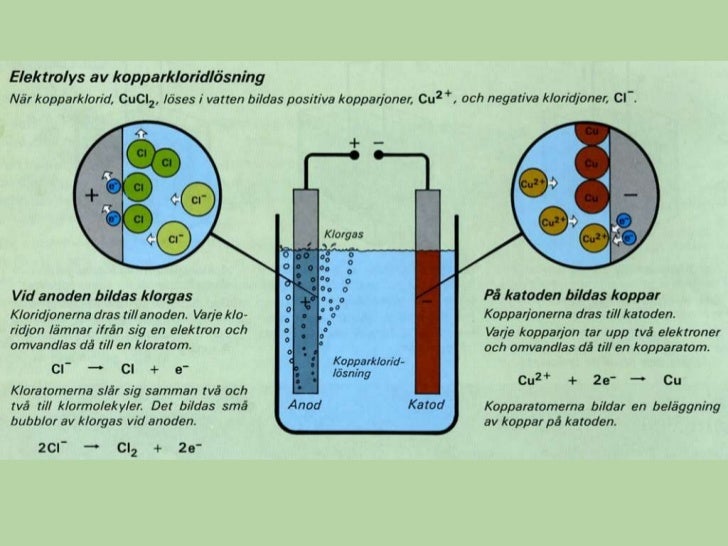
Elektrolys (video från Helixgymnasiet)
Förhör
FÖRÄDLING AV JÄRNMALM
1. Järnmalmen bryts och krossas
Järnmalm finns i berggrunden som järnoxider:
- svartmalm (magnetit) Fe3O4
- blodstensmalm (hematit) Fe2O3
2. Anrikning
Järnmalmen separeras från övrigt material t.ex. genom att använda roterande magneter.
3. Reduktion av järn i masugnen
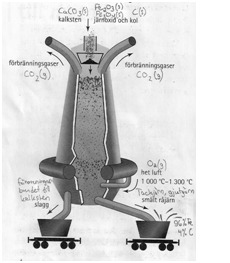
Kol reagerar med syre och det bildas kolmonoxid och det frigörs värme (exoterm reaktion).
2 C + O2 -> 2 CO + värme
Kolmonoxiden tar syre åt sig från järnoxider och blir till koldioxid och järn reduceras (exoterma reaktioner).
Fe2O3 + 3 CO -> 2 Fe + 3 CO2 + värme
Fe3O4 + 4 CO -> 3 Fe + 4 CO2 + värme
4. Färskning av råjärn ger stål
Kolhalten minskas från 4 % till under 1,7 % och man får stål d.v.s. smidbart järn.
5. Rostfritt stål
Rostfritt stål är en legering (blandning) av järn och krom.
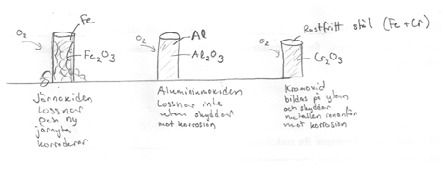
KORROSION
Kemisk korrosion
Kemisk korrosion innebär oxidation av en oädel metall då den utsätts för luftens syre och fukt.
Elektrokemisk korrosion
Då två metaller är i kontakt med varandra via en elektrolyt, korroderar den oädlare metallen mycket snabbt med den ädlare metallen skyddas mot korrosion.
Hur kan man skudda en metall (t.ex. järn) mot korrosion?
Man kan förhindrar luft och fukt från att komma i kontant med metallen t.ex. genom att
- måla den
- överdra den med plast eller gummi
- ytbehandla den med vattenavstötande oljor och fetter
Man kan använd en offermetall vilket innebär att:
- Den ädlare metallen skyddas mot korrosion av en oädlare metall som korroderar.
- T.ex. järn kan skyddas genom att använda zink som offermetaller. Så länge zinken korroderar skyddas järn mot korrosion.
Vilken av metallerna järn och aluminium klarar sig bättre mot korrosion?
Aluminium regerar snabbt med syre eftersom den är oädlare.