Ionisidos
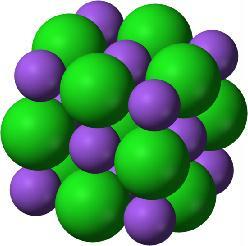
Ionisidos on vahvan sähköisen vetovoiman ilmentymä, jota esiintyy negatiivisten ja positiivisten ionien välillä. Ionisidosten muodostamaa yhdistettä kutsutaan ioniyhdisteeksi tai suolaksi. Poolisen kovalenttisen sidoksen ja ionisidoksen rajaksi määritellään usein elektronegatiivisuusero 1,7.
Selvää rajaa kovalenttisen ja ionisidoksen välillä ei kuitenkaan ole, koska elektronegatiivisuuseron kasvaessa sidoksen ioniluonne kasvaa asteittain. Ionisidos on vahva sidostyyppi, mistä johtuen ioniyhdisteillä on korkea sulamis- ja kiehumispiste.
Ioniyhdisteessä jokainen ioni pyrkii saamaan lähelleen mahdollisimman monta erivarauksista ionia ja pitämään samanvarauksiset ionit mahdollisimman etäällä. Tästä seuraa, että ioniyhdiste kiteytyy sopivissa olosuhteissa säännölliseksi kolmiulotteiseksi hilarakenteeksi, ionihilaksi. Ionihila pysyy koossa sähköisten vetovoimien vaikutuksesta.
Hyvä esimerkki suolasta on natriumkloridi eli ruokasuola. Se koostuu Na+- ja Cl--ioneista, joiden elektronegatiivisuusero on 2,1. Natriumkloridilla on kuutionmuotoinen ionihila, jossa kukin kloridi-ioni sitoutuu kuuteen natriumioniin ja kukin natriumioni vastaavasti kuuteen kloridi-ioniin.