2. Metallien ominaisuudet
1. Virittäytyminen – mitä muistat metallien ominaisuuksista?
2. Kemialliset ja fysikaaliset ominaisuudet
 Metallien suosio perustuu niiden kemiallisiin ja fysikaalisiin ominaisuuksiin, kuten korroosionkestoon, kovuuteen ja muokattavuuteen. Korroosiolla tarkoitetaan metallin hapettumista. Arkikielessä raudan korroosiota nimitetään ruostumiseksi.
Metallien suosio perustuu niiden kemiallisiin ja fysikaalisiin ominaisuuksiin, kuten korroosionkestoon, kovuuteen ja muokattavuuteen. Korroosiolla tarkoitetaan metallin hapettumista. Arkikielessä raudan korroosiota nimitetään ruostumiseksi.
Metalleille tyypillisiä ominaisuuksia ovat kovuus, muokattavuus, läpinäkymättömyys, kiilto, suuri tiheys, korkea sulamispiste sekä hyvä lämmön- ja sähkönjohtavuus. Metallit ovat huoneen lämpötilassa kiinteitä elohopeaa ja radonia lukuunottamatta. Elohopea on neste ja radon kaasu huoneen lämpötilassa. Metallien liukoisuus veteen vaihtelee. Jotkin metallit kuten alkalimetallit reagoivat veden kanssa kiivaasti, mutta toiset kuten jalometallit eivät ollenkaan.
Kuva: Metallit ovat tuttuja Kalevalasta. Seppä Ilmarisella kerrotaan olleen raudan kesyttämisen ja sammon takomisen taito. Maalaus: Akseli Gallen-Kallela.
3. Kovuus
Metallit ovat kiinteinä kovia, mutta muokattavia. Esimerkiksi kivet ovat kovia, mutta murtuvat iskusta. Metallin kovuus voidaan määrittää esimerkiksi raaputuskokeella. Kovempi metalli naarmuttaa pehmeämpää. Metallin kovuutta voidaan parantaa lisäaineilla ja muokkaamisella. Raaputuskovuutta mitataan Mohsin asteikolla.

4. Muokattavuus
Metalleja voidaan muokata haluttuun muotoon hiomalla, takomalla, valssaamalla, sulattamalla ja valamalla. Takomisessa kuumaa metallia muotoillaan hakkaamalla sitä vasaralla alasimen päällä. Lopputulos viimeistellään hionnalla. Valssaamisessa metalli asetetaan kahden rullan väliin, jolloin paksu metallilevy ohenee. Tekniikaltaan menetelmä muistuttaa mankeloimista. Valssaamalla yhdestä grammasta kultaa saadaan 2–2,5 kilometriä kultalankaa. Metallia sulattamalla ja valamalla valmistetaan muun muassa metalliharkkoja.

5. Läpinäkymättömyys
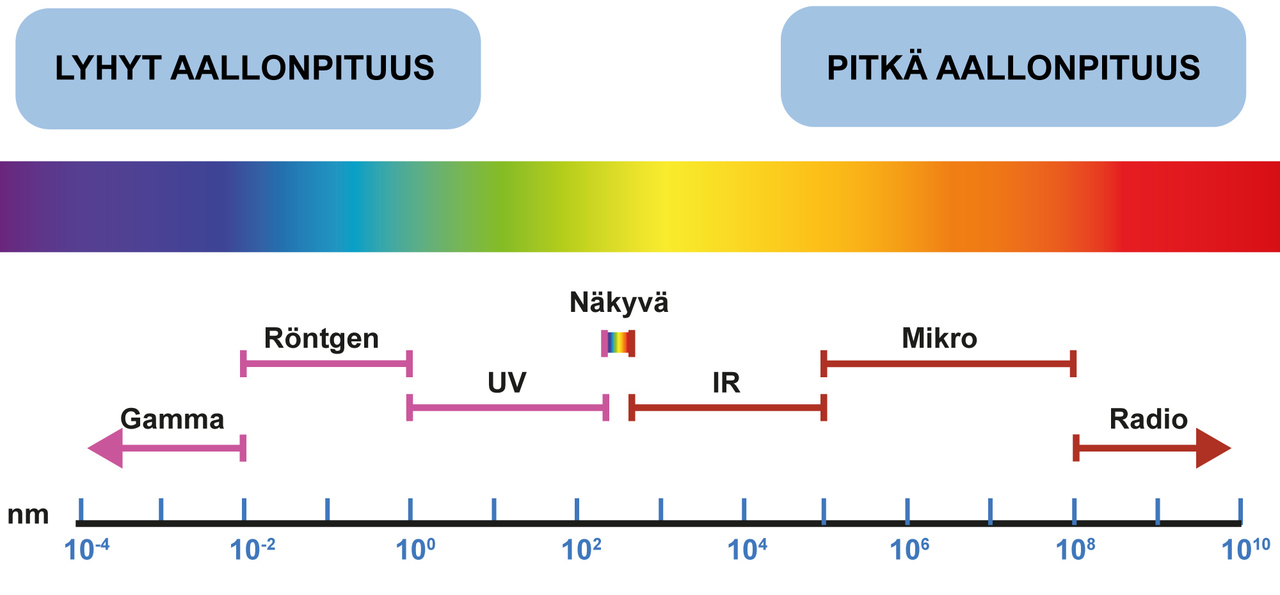
Näkyvä valo voi läpäistä hyvin ohuen metallikerroksen, mutta paksumpaa ei ollenkaan. Näkyvä valo on sähkömagneettista aaltoliikettä, joilla on tietty aallonpituus. Sinisellä valolla on lyhin aallonpituus, punaisella pisin. Hyvin lyhytaaltoiset röntgen- ja gammasäteily läpäisevät metalleja jonkin verran. Niiltä suojautuminen on tärkeää lääketieteellisessä kuvauksissa, ydinvoimaloissa ja hiukkastutkimuslaitoksissa. Pidempiaaltoinen säteily (IR, mikro, radio) läpäisee metalleja huonosti. Jo millimetrin paksuinen metallilevy estää tehokkaasti mikroaaltosäteilyn läpäisyä. Ominaisuus on tärkeä mikroaaltouuneissa.
Erikoistekniikoilla, kuten nanotekniikalla, voidaan valmistaa myös läpinäkyvää metallia. Sitä käytetään esimerkiksi luodinkestävässä lasissa. Läpinäkyvään metalliin perustuvat luodinkestävät lasit ovat kovempia ja kevyempiä, kuin perinteisen luodinkestävät lasit.

6. Kiilto
Metallit heijastavat sähkömagneettisia aaltoja hyvin etenkin näkyvän valon aallonpituusalueella. Hyvin hiottu metallipinta heijastaa lähes kaiken siihen tulevan valon. Hyvin tehokkaasti valoa heijastavia metallipintoja käytetään peileinä. Tavalliset tasopeilit ovat valmistettu lasista, jonka pintaan on kemiallisella tekniikalla kiinnitetty ohut metallikerros. Metalli on yleensä alumiinia tai hopeaa.

7. Korkea sulamispiste
Metallin sulamispisteet ovat korkeita, pois lukien elohopea (−39 oC) ja radon (−79 oC). Korkean sulamispisteen ansiosta metalleista on valmistettu aseita, työkaluja ja keittiövälineitä jo vuosituhansia sitten. Yksi korkeimmista sulamispisteistä on volframilla (3410 oC), minkä ansiosta sitä käytetään lamppujen ja polttimoiden hehkulankana.
Raudan sulamispiste on 1 535 oC ja kullan 1 064 oC. Tinan sulamispiste 232 oC on sen verran alhainen, että sen sulattaminen onnistuu uutena vuotena hellan levylle asetetussa metallikauhassa. Kauhakin lämpenee, mutta lämmönjohtumiseen vaikutetaan niittaamalla kuppiosa kiinni kahvaan ja käyttämällä pitkää vartta. Niitattu kahva johtaa lämpöä huonommin kuin valettu kahva. Pitkä varsi tehostaa lämmön johtumista ympäristöön.

7. Suuri tiheys
 Metallit pakkaantuvat tiiviisti. Kaikki jaksollisen järjestelmän tiheimmät aineet ovat metalleja. Maitotölkillinen rautaa painaa noin 7,9 kilogrammaa, mutta sama määrä lyijyä 11,4 kilogrammaa, elohopeaa 13,5 kilogrammaa ja kultaa 19,3 kilogrammaa.
Metallit pakkaantuvat tiiviisti. Kaikki jaksollisen järjestelmän tiheimmät aineet ovat metalleja. Maitotölkillinen rautaa painaa noin 7,9 kilogrammaa, mutta sama määrä lyijyä 11,4 kilogrammaa, elohopeaa 13,5 kilogrammaa ja kultaa 19,3 kilogrammaa.
Metalleista keveimmät kuitenkin kelluvat veden pinnalla. Esimerkiksi litium (Li), kalium (K) ja natrium (Na) ovat tiheydeltään pienempiä kuin vesi. Keveytensä ansiosta litium on suosittu materiaali matkapuhelimien, tietokoneiden ja kameroiden akuissa.

8. Lämmönjohtokyky
Metallit johtavat hyvin lämpöä. Metallien hyvää lämmönjohtavuutta hyödynnetään lämmönsiirrossa esimerkiksi kattiloissa ja kotien lämpöpatteriverkostossa. Metallien hyvästä lämmönjohdosta on haittaa esimerkiksi saunassa. Saunassa olevan metallin ja lauteen lämpötila on sama, mutta metalli johtaa lämpöä tehokkaammin kuin puu. Lämmönsiirtyminen metallista ihoon voi olla niin nopea, että muodostuu palovamma. Vastaavasti pakkasella sama ilmiö saa metallin tuntumaan kylmemmältä kuin puu. Metalleista parhaiten lämpöä johtaa hopea. Kulta ja kupari johtavat lämpöä lähes yhtä hyvin, mutta kuparia käytetään eniten sen edullisuuden vuoksi.

Rännistä pilkistää muovikuorella suojattu metallinen lämpövastus. Sen tarkoituksena on estää syöksytorven jäätyminen.
9. Sähkönjohtokyky
Metallit johtavat hyvin sähköä. Hyvää sähkönjohtokykyä käytetään sähköjakelussa ja elektroniikassa. Metallien hyvästä sähkönjohtokyvystä on haittaa esimerkiksi hisseissä, kaiteissa ja elektroniikan työlinjastoissa, joissa muodostuu hankaussähköä. Hopealla on metalleista paras sähköjohtokyky, mutta kupari johtaa sähköä melkein yhtä hyvin. Hopea on kuitenkin selvästi kalliimpaa kuin kupari, joten paremmasta johtavuudesta saatava hyöty ei ole taloudellisesti kannattavaa. Kulta johtaa sähköä huonommin kuin hopea ja kupari. Kultaa käytetään jonkin verran johtojen liittimissä.

10. Metalliatomit ja -yhdisteet
 Metalliatomin ja siitä muodostuneen yhdisteessä olevan metalli-ionin kemialliset, fysikaaliset ja fysiologiset ominaisuudet voivat poiketa merkittävästi toisistaan.
Metalliatomin ja siitä muodostuneen yhdisteessä olevan metalli-ionin kemialliset, fysikaaliset ja fysiologiset ominaisuudet voivat poiketa merkittävästi toisistaan.
Esimerkiksi kuvan natrium (Na) on harmaata, pehmeää metallia, jota voi leikata veitsellä. Se reagoi veden kanssa kiivaasti muodostaen emäksisen liuoksen. Ruokasuolassa oleva natriumioni (Na+) sen sijaan reagoi veden kanssa vain vähän. Se on osa merien- ja kudosnesteen suolaisuutta. Metallinen natrium on elimistölle myrkyllistä, mutta ionimuotoinen välttämätön hivenaine, jota ilman solut eivät toimi.
11. Metallisidos selittää monia metallien ominaisuuksia

Metallien ominaisuudet kovuus, muokattavuus, läpinäkymättömyys, kiilto, suuri tiheys, korkea sulamispiste sekä hyvä lämmön- ja sähkönjohtavuus johtuvat metallisidoksesta. Siinä metalli-ionien ja elektronien väliset sähköiset voimat pitävät rakenteen tiukasti kasassa, mutta ne eivät aseta mitään suuntavaatimuksia, joten ionit pakkaantuvat mahdollisimman lähelle toisiaan.
![]() Metalli
Metalli
Metallissa atomit järjestäytyvät säännölliseen kolmiulotteiseen rakennelmaan, jota nimitetään hilaksi. Se rakentuu harvoin täydelliseksi, ja yleensä siinä on virheitä. Hilaan muodostuu pienempiä alueita, kiteitä, joiden sisällä hila on täydellinen. Kiteiden välillä on rajapintoja. Rajapintojen määrä vaikuttaa metallin ominaisuuksiin, kuten kovuuteen. Jos rajapintoja on paljon, metalli on kovaa, mutta se murtuu helposti.

 Metalleilla on atomin uloimmalla elektronitasolla yleensä 1–3 elektronia. Ne irtoavat melko helposti ydinten vaikutuspiiristä. Erityistä on se, että metallissa ulkoelektronit ovat kaikkien atomiytimien yhteiskäytössä. Ne muodostavat negatiivisesti varautuneen niin sanotun elektronimeren, joka pitää positiivisesti varautuneita metalli-ioneja yhdessä tiiviisti pakkautuneena. Sitä nimitetään metallisidokseksi. Metallisidos liittää metalli-ionit tiukasti toisiinsa, muttei vaadi niiden pysyvää järjestystä. Kokonaisuutena elektronien ja protonien määrä pysyy samana, joten metalli on alkuainemuodossaan ulospäin sähköisesti neutraali.
Metalleilla on atomin uloimmalla elektronitasolla yleensä 1–3 elektronia. Ne irtoavat melko helposti ydinten vaikutuspiiristä. Erityistä on se, että metallissa ulkoelektronit ovat kaikkien atomiytimien yhteiskäytössä. Ne muodostavat negatiivisesti varautuneen niin sanotun elektronimeren, joka pitää positiivisesti varautuneita metalli-ioneja yhdessä tiiviisti pakkautuneena. Sitä nimitetään metallisidokseksi. Metallisidos liittää metalli-ionit tiukasti toisiinsa, muttei vaadi niiden pysyvää järjestystä. Kokonaisuutena elektronien ja protonien määrä pysyy samana, joten metalli on alkuainemuodossaan ulospäin sähköisesti neutraali.
Metalli-ionin koko ja varaus selittävät metallin kovuuden ja tiheyden. Metallit, jotka luovuttavat vain yhden elektronin metallisidokseen ja joiden ionisäde on suuri, ovat pehmeitä ja kevyitä. Tällaisia ovat esimerkiksi alkalimetallit. Metallit, jotka luovuttavat monia elektroneja ja joiden ionisäde on pieni, ovat kovia ja tiheitä. Tällaisia ovat esimerkiksi sivuryhmien metallit.

Magnesium on kuvan metalleista kovinta ja tiheintä, sillä jokainen magnesiumatomi luovuttaa metallisidokseen kaksi elektronia ja magnesiumionin säde on pienempi kuin natriumin tai kaliumin. Kalium ja natrium luovuttavat metallisidokseen yhden elektronin. Näistä kalium pehmeämpää ja keveämpää kuin natrium, sillä kaliumin ionisäde on suurempi.
Yhteiset vapaasti liikkuvat sidoselektronit selittävät metallin muokattavuuden, korkean sulamispisteen ja sähkönjohtavuuden. Niiden ansiosta metalli-ionit voivat liikkua toistensa ohi sidoksen katkeamatta. Jo yksi elektroni voi sitoa hetkittäisesti useita metalli-ioneja. Yhteisiä sidoselektroneja on paljon, ja ne liittävät ionit lujasti yhteen. Ionien erottamiseen toisistaan tarvitaan paljon energiaa, mikä havaitaan korkeina sulamispisteinä. Sähkönjohtavuuteen tarvitaan vapaasti liikkuvia elektroneja. Niitä metallissa on paljon, ja siksi ne johtavat hyvin sähköä.

Sidoselektronien suuri lukumäärä ja likimain samat energiat selittävät metallikiillon. Sähkömagneettinen säteily saa sidoselektronit elektronit värähtelemään. Ne virittyvät korkeammalle energiatilalle ja viritystilan purkautuessa ylimääräinen energia vapautuu sähkömagneettisena säteilynä esimerkiksi valona. Sileä ja tiivis metallipinta heijastaa suuren osan valosta. Se osa valosta, joka ei heijastu eikä aiheuta virittymistä, imeytyy metallihilaan täydellisesti ja saa aikaan metallin läpinäkymättömyyden.

Metallien hyvä lämmönjohtuvuus perustuu metalli-ionien tiiviiseen pakkautumiseen. Tiiviissä pakkauksessa hiukkasvärähtely siirtyy helposti ionista toiseen. Se selittää myös metallien hyvän äänenjohtavuuden.

Tiivistelmä
- Metalleille tyypillisiä ominaisuuksia ovat kovuus, muokattavuus, läpinäkymättömyys, kiilto, suuri tiheys, korkea sulamispiste sekä hyvä lämmön- ja sähkönjohtavuus.
- Ominaisuudet johtuvat metallisidoksesta.
- Metallisidoksessa ulkoelektronit voivat liikkua vapaasti ja muodostavat niin kutustun elektronimeren.
- Metalliatomin ja siitä muodostuneen yhdisteessä olevan metalli-ionin kemialliset, fysikaaliset ja fysiologiset ominaisuudet voivat poiketa merkittävästi toisistaan.
