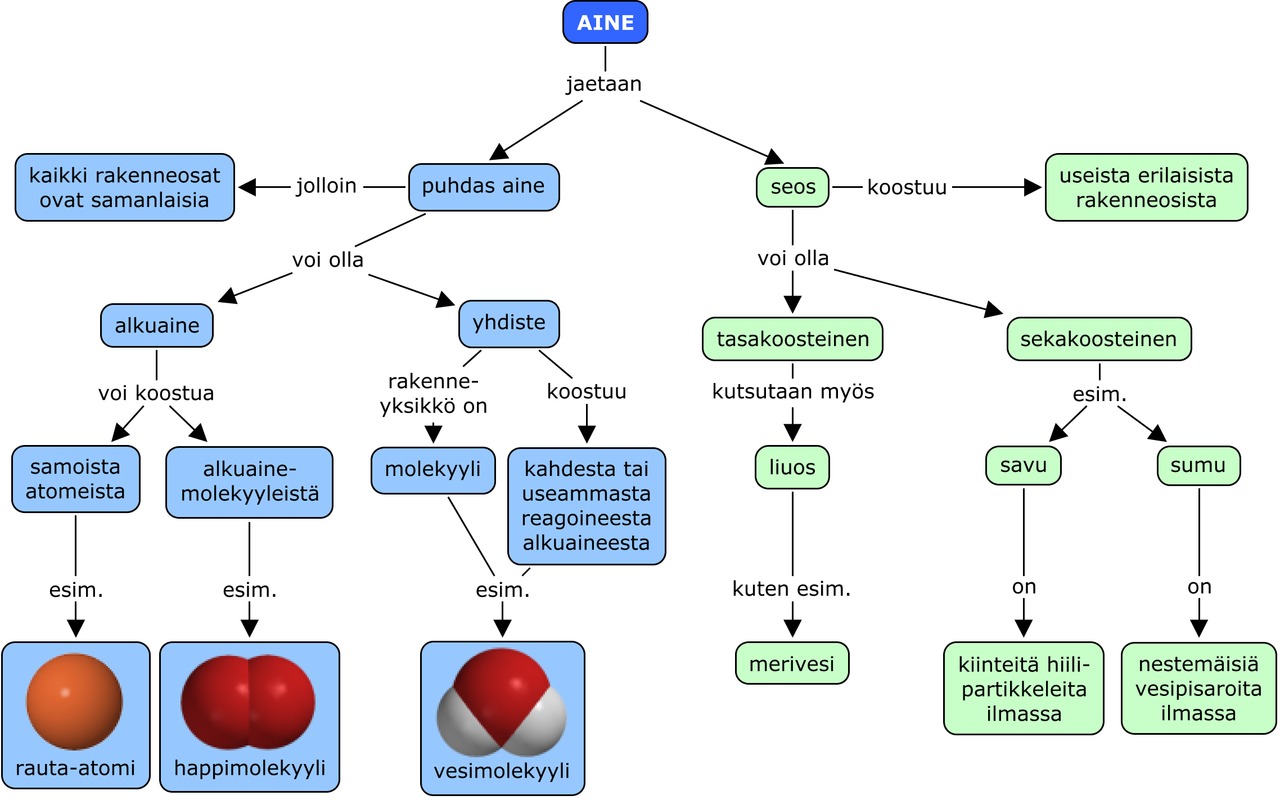
4. Kemiallinen reaktio ja yhdiste
Hapen ja vedyn välinen kemiallinen reaktio
Happi- ja vetymolekyylien sidokset katkeavat ja uusia sidoksia syntyy. Atomit järjestyvät uudella tavalla, jolloin kaksi vetyatomia muodostavat kemiallisen sidoksen yhden happiatomin kanssa. Syntyy uusi molekyyli jossa on kahta eri alkuainetta, vetyä ja happea. On tapahtunut kemiallinen reaktio, koska aineet ovat muuttuneet toisiksi aineiksi.
Koska tässä uudessa molekyylissä on kaksi eri alkuainetta (H ja O) sitoutunut kemiallisesti toisiinsa, se on yhdiste, ei puhdas alkuaine.
Molekyylin esittäminen kemiallisin merkein
Mietitäänpä, miten tämä uusi molekyyli voitaisiin kirjoittaa kemiallisin merkein:
-
Mitä alkuaineita molekyylissä on? Vetyä H ja happea O.
-
Montako atomia kutakin alkuainetta molekyylissä on? Kaksi vetyatomia eli H2 ja yksi happiatomi eli O.
-
Siis syntyneen molekyylin kemiallinen kaava on H2O. “Hookaksoo” on tutun aineen, veden kemiallinen kaava.
Reaktioyhtälön tasapainottaminen
Kemian reaktioyhtälöt kirjoitetaan seuraavasti:
- Kirjoitetaan vasemmalle lähtöaine tai -aineet, nuoli ([[$ \rightarrow $]]) väliin ja oikealle tuote tai tuotteet.
- Jos lähtöaineita tai tuotteita on useampi kuin yksi, niin niiden väliin laitetaan + -merkki:
Esimerkki: Hapen ja vedyn välisestä reaktiosta syntyy vettä.
Sama kemiallisin merkein:
Reaktioyhtälön tasapainottaminen edellyttää, että kunkin alkuaineen atomeja on nuolen molemmin puolin yhtä monta. Vetyatomeja on kyllä molemmin puolin kaksi, mutta happiatomeja on lähtöaineiden puolella kaksi ja tuotteiden puolella vain yksi. Näin voit tasapainottaa tämän reaktioyhtälön:
[[$ 2\text{ H}_{2}+\text{O}_{2}\rightarrow 2 \text{ H}_{2}\text{O} $]]
Voit harjoitella reaktioyhtälöiden tasapainottamista myös tällä Java-simulaatiolla.
Reaktionopeus
Kemiallisen reaktion reaktionopeuteen vaikuttavat useat tekijät:
- ainepari eli mitkä aineet reagoivat keskenään
- aineen hienojakoisuus
- aineiden väkevyys
- lämpötila
- sekoitus
- katalyytti
Energian vapautuminen ja sitoutuminen

Toiset kemialliset reaktiot taas puolestaan sitovat energiaa ympäristöstään jäähdyttäen sitä samalla. Usein tosin fysikaaliset olomuodon muutokset ovat arkielämän kannalta käyttökelpoisempia keinoja viilentää vaikkapa ruoka-aineita (jääkaappi).

Tässä videossa nähdään ruokasoodan ja etikan välinen reaktio, jossa sitoutuu energiaa. Energiaa sitovat reaktiot ovat endotermisiä reaktioita ja energiaa vapauttavat ovat eksotermisiä reaktioita.