22. Sähkön avulla kemiaa
Johdanto
Edellisessä kappaleessa tuotettiin kemiallisesti sähköä. Tässä luvussa tehdään toisinpäin, sähkövirta saa aikaan kemiallisia reaktioita. Tähän tarvitaan jännitelähde sekä ioneja sisältävä ja siis sähköä johtava elektrolyyttiliuos.
Veden elektrolyysi
Vesimolekyylit voidaan hajottaa sähkövirran avulla vety- ja happikaasuiksi, H2 ja O2. Negatiivisella kohtiolla syntyy vetyä ja positiivisella kohtiolla happea.
Veden elektrolyysi on yksi tapa tuottaa alkuainemuodossa olevaa vetyä puhtaaksi polttoaineeksi. Elektrolyysin avulla voidaan valmistaa myös muita alkuaineita, kuten natriumia, alumiinia ja klooria.
Veden elektrolyysi on yksi tapa tuottaa alkuainemuodossa olevaa vetyä puhtaaksi polttoaineeksi. Elektrolyysin avulla voidaan valmistaa myös muita alkuaineita, kuten natriumia, alumiinia ja klooria.
Metallien päällystäminen ja puhdistaminen elektrolyysillä
Aiemmin olet oppinut, että kun jalompi metalli on ioneina ja epäjalompi metalli atomeina, tapahtuu “roolin vaihdos”. Jalompi metalli sakkautuu alkuainemuotoon, ja epäjalompi liukenee ioneina liuokseen.
Näin tapahtuu esimerkiksi, kun kuparinaula viedään hopeaioneja sisältävään liuokseen. Hopea sakkautuu kuparinaulan pinnalle ja liuokseen ilmestyvä sininen väri ilmaisee siihen liuenneen kupari-ioneja.
Edelleen tiedät, että toisin päin reaktio ei itsekseen tapahdu. Mutta jos on tarvetta päällystää jalompi metalli epäjalommalla, niin reaktio voidaan pakottaa tapahtumaan sähkövirran avulla. Vaikka sinkki on epäjalompi kuin rauta, auton teräksestä valmistettu kori päällystetään usein sinkillä elektrolyyttisesti. Sinkkikerros suojaa koria ruostumiselta.


Hyvin puhtaan kuparin valmistamisessa käytetään elektrolyyttistä puhdistusmenetelmää.
Näin tapahtuu esimerkiksi, kun kuparinaula viedään hopeaioneja sisältävään liuokseen. Hopea sakkautuu kuparinaulan pinnalle ja liuokseen ilmestyvä sininen väri ilmaisee siihen liuenneen kupari-ioneja.
Edelleen tiedät, että toisin päin reaktio ei itsekseen tapahdu. Mutta jos on tarvetta päällystää jalompi metalli epäjalommalla, niin reaktio voidaan pakottaa tapahtumaan sähkövirran avulla. Vaikka sinkki on epäjalompi kuin rauta, auton teräksestä valmistettu kori päällystetään usein sinkillä elektrolyyttisesti. Sinkkikerros suojaa koria ruostumiselta.


Hyvin puhtaan kuparin valmistamisessa käytetään elektrolyyttistä puhdistusmenetelmää.
Sinkkikloridin vesiliuoksen elektrolyysi
 Sinkkikloridin vesiliuos sisältää positiivisia sinkki-ioneja Zn2+ sekä negatiivisia kloridi-ioneja Cl-.
Sinkkikloridin vesiliuos sisältää positiivisia sinkki-ioneja Zn2+ sekä negatiivisia kloridi-ioneja Cl-.Positiivinen kohtio (+) jossa on pulaa elektroneista, vetää negatiivisia kloridi-ioneja puoleensa. Kun nämä ionit kohtaavat kohtion pinnan, kloridi-ionit luovuttavat uloimmalta kuoreltaan yhden elektronin ja hapettuvat varauksettomiksi klooriatomeiksi. Nämä klooriatomit yhdistyvät kahden atomin muodostamiksi kloorimolekyyleiksi Cl2. Syntyy kloorikaasua.
Negatiivinen kohtio (– ) jossa on ylimäärin elektroneja, vetää positiivisia sinkki-ioneja puoleensa. Kun nämä ionit kohtaavat kohtion pinnan, sinkki-ionit ottavat vastaan uloimmalle elektronikuorelleen kaksi elektronia ja pelkistyvät varauksettomiksi sinkkiatomeiksi. Atomit kerrostuvat kohtion pintaan, ja syntyy sinkkimetallia.
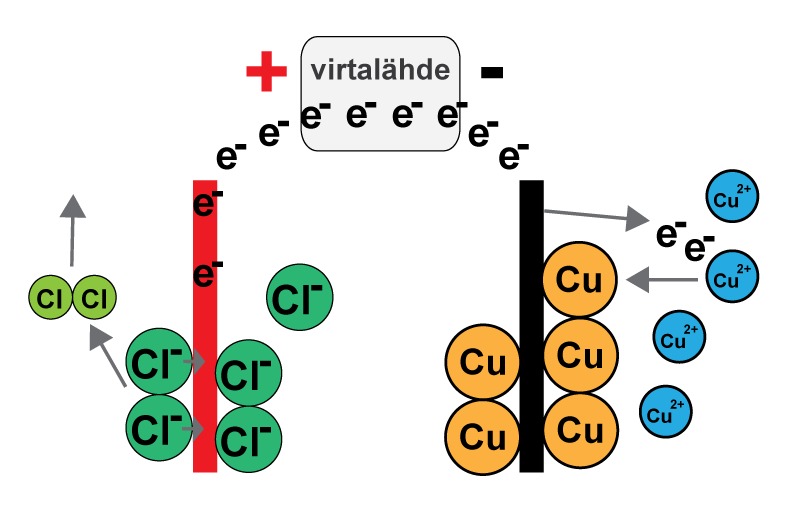
Elektrolyysi toimii samalla tavalla myös kuparikloridin CuCl2 vesiliuoksessa. Elektrolyysin seurauksena kupari pelkistyy ja varauksettomat kupariatomit kertyvät negatiivisen kohtion pintaan. Positiivisella kohtiolla kloridi-ionit Cl- luovuttavat elektronin, ja hapettuvat kloorikaasuksi Cl2.
Akku
Edellisessä luvussa tehtiin kemian avulla sähköä ja tässä luvussa toisin päin. Yhdistetään nyt nämä molemmat tutustumalla akun eli ladattavan jännitelähteen toimintaan:
A. Lataus
Sähkön avulla saadaan aikaan kemiallisia reaktioita molemmilla lyijylevyillä. Seurauksena syntyy jännite positiivisen ja negatiivisen lyijykohtion eli navan välille.
B. Purkaminen
Kun virtapiiri napojen välillä suljetaan, elektronit pääsevät liikkumaan ja näin saadaan navoilla tapahtuvien kemiallisten reaktioiden avulla sähkövirtaa.
A. Lataus
Sähkön avulla saadaan aikaan kemiallisia reaktioita molemmilla lyijylevyillä. Seurauksena syntyy jännite positiivisen ja negatiivisen lyijykohtion eli navan välille.
B. Purkaminen
Kun virtapiiri napojen välillä suljetaan, elektronit pääsevät liikkumaan ja näin saadaan navoilla tapahtuvien kemiallisten reaktioiden avulla sähkövirtaa.