16. Ionisidos ja ioniyhdisteet
Johdanto
 Oletko joskus meressä uidessasi hörpännyt vettä suuhusi? Maistuu suolaiselle. Maistuu ioniyhdisteelle.
Oletko joskus meressä uidessasi hörpännyt vettä suuhusi? Maistuu suolaiselle. Maistuu ioniyhdisteelle.Meille kaikille tutuin ioniyhdiste on ruokasuola, joka koostuu natriumista ja kloorista. Natrium on metalli ja kloori on epämetalli. Ruokasuola on siis yhdiste, jossa natriumin ja kloorin välillä on kemiallinen sidos. Tämä sidos, niin voimakas kuin se onkin, on herkkä katkeamaan joutuessaan veden kanssa kosketuksiin. Siinä on siis jotain erilaista verrattuna jo tuttuihin molekyylisidoksiin.
Näkyvällä kemian tasolla ilmiö näyttää esimerkiksi tältä:
Silmille näkymättömällä atomitasolla se näyttää taas tältä:
Tutki suolan liukenemista tällä Java-simulaatiolla myös itse.
Ionisidoksen muodostuminen
 Molekyylisidoksessa molemmat atomit joiden välille sidos syntyy, muodostavat yhden tai useamman yhteisen elektroniparin. Ionisidos on molekyylisidoksen erikoistapaus, jossa tämä elektronipari tai parit sijoittuvat suurimmaksi osaksi vain toisen sidokseen osallistuvan atomin puolelle. Tämän atomin ympärillä on ylimäärin elektroneja protoneihinsa verrattuna ja siksi sen kohdalla varaus on negatiivinen. Vastaavasti toisen atomin puolella on positiivinen varaus, koska sen ympärillä on vähemmän elektroneja kuin mitä sen ytimessä on protoneja. Tämä atomien välinen varausero synnyttää sähköisen vetovoiman ja voimakkaan kemiallisen sidoksen, ionisidoksen.
Molekyylisidoksessa molemmat atomit joiden välille sidos syntyy, muodostavat yhden tai useamman yhteisen elektroniparin. Ionisidos on molekyylisidoksen erikoistapaus, jossa tämä elektronipari tai parit sijoittuvat suurimmaksi osaksi vain toisen sidokseen osallistuvan atomin puolelle. Tämän atomin ympärillä on ylimäärin elektroneja protoneihinsa verrattuna ja siksi sen kohdalla varaus on negatiivinen. Vastaavasti toisen atomin puolella on positiivinen varaus, koska sen ympärillä on vähemmän elektroneja kuin mitä sen ytimessä on protoneja. Tämä atomien välinen varausero synnyttää sähköisen vetovoiman ja voimakkaan kemiallisen sidoksen, ionisidoksen.Käytännössä atomi johon elektronipari tai parit ovat suuntautuneet, on ominut kokonaan yhden tai useamman elektronin toiselta atomilta. Tämän vuoksi sitä ei kutsuta enää atomiksi, vaan negatiiviseksi ioniksi eli anioniksi. Vastaavasti atomia joka on luovuttanut yhden tai useamman elektroninsa, kutsutaan positiiviseksi ioniksi eli kationiksi.
Kuorimallin avulla ionisidoksen synty voidaan mallintaa helposti silloin, kun käsitellään vain kahta atomia joista toinen on metalli ja toinen epämetalli. Esimerkkinä natrium Na ja kloori Cl:
[[$ \text{Na} + \text{Cl} \rightarrow \text{Na}^+ + \text{Cl}^- $]]
Natriumatomi luovuttaa uloimman kuorensa ainoan elektronin klooriatomille. Samalla sen 3. kuori tyhjenee ja uloimmaksi elektroneja sisältäväksi kuoreksi muodostuu 2. kuori. Näin natrium saavuttaa oktettirakenteen, eli saa 8 elektronia uloimmalle kuorelleen. Nyt natriumilla on yksi elektroni (10) vähemmän kuin ytimessä on protoneja (11) ja sen vuoksi se saa varauksen +1 (11 - 10 = +1). On muodostunut natriumioni Na+.
Vastaavasti klooriatomi on ottanut vastaan yhden elektronin uloimmalle kuorelleen ja saavuttaa myös oktettirakenteen. Kloorilla on nyt yksi elektroni (18) enemmän kuin sen ytimessä on protoneja (17) ja saa varauksen -1 (17 - 18 = -1). Siitä on muodostunut kloori- eli kloridi-ioni Cl-.
Toisena kuorimallin käyttöesimerkkinä tarkastellaan tilannetta, kuinka ioniyhdiste voi muodostua useammasta kuin kahdesta atomista. Esimerkkinä otetaan kalsiumin ja fluorin tapaus:
[[$ \text{Ca} + 2\text{F} \rightarrow \text{Ca}^{2+} + 2\text{F}^- $]]

Kalsiumfluoridia.
Ioniyhdisteet kiinteässä olomuodossa
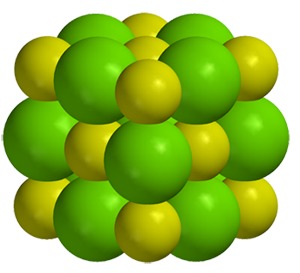 Ioniyhdiste koostuu siis positiivisista ja negatiivisista ioneista, jotka muodostavat kiinteässä olomuodossa ollessaan säännöllisen, kovan kiderakenteen. Koska erimerkkisten ionien väliset sähköiset vetovoimat ovat vahvoja, ovat ioniyhdisteiden sulamispisteet korkeita. Esimerkiksi kalsium- ja fluori-ionien muodostama kide sulaa vasta n. 1400 ৹C lämpötilassa.
Ioniyhdiste koostuu siis positiivisista ja negatiivisista ioneista, jotka muodostavat kiinteässä olomuodossa ollessaan säännöllisen, kovan kiderakenteen. Koska erimerkkisten ionien väliset sähköiset vetovoimat ovat vahvoja, ovat ioniyhdisteiden sulamispisteet korkeita. Esimerkiksi kalsium- ja fluori-ionien muodostama kide sulaa vasta n. 1400 ৹C lämpötilassa.Vesimolekyyleillä on kuitenkin kyky tunkeutua kiteen ionien väliin ja näin heikentää niiden välistä sähköistä vetovoimaa. Niinpä ionit liukenevat veteen ja pääsevät siellä vapaasti liikkumaan. Ne voivat toimia sähkön kuljettajina ja siksi ioniyhdisteiden vesiliuokset johtavat sähköä, kuten myös ioniyhdisteiden sulatteet.
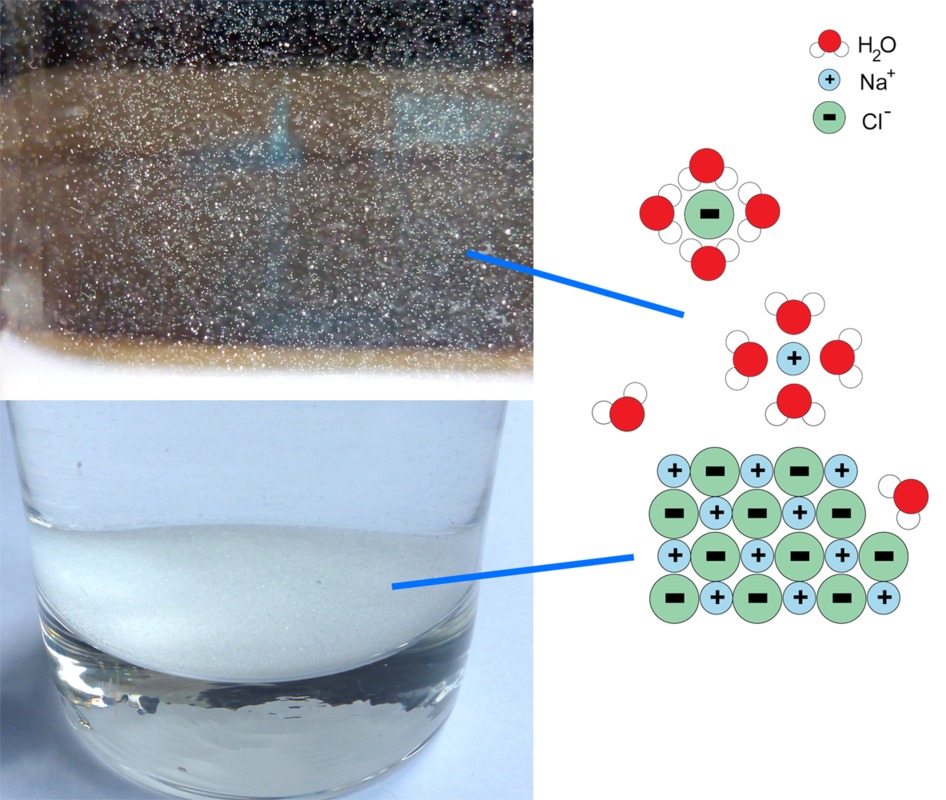
Video erilaisten yhdisteiden sähkönjohtavuudesta. Tarkkaile johtokykymittarin punaista valoa.
Vesimolekyylien hajoaminen ioneiksi
Hyvin pieni osa vesimolekyyleistä hajoaa itsestään positiiviseksi ja negatiiviseksi ioniksi:
[[$ 2\text{H}_2\text{O} \rightarrow \text{H}_3\text{O}^+ + \text{OH}^- $]]
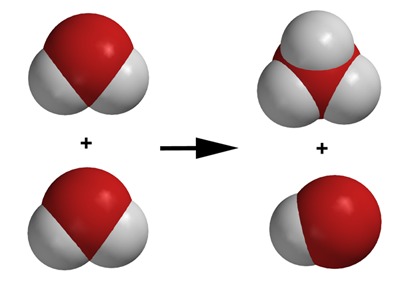
Huomaa myös, että ioni voi koostua kahdesta tai useammasta joko saman tai eri alkuaineen atomeista, jotka ovat sitoutuneet molekyylisidoksin toisiinsa. Näitä kutsutaan moniatomisiksi ioneiksi.
Siis mitä tässä oikein tapahtui? Katsopa video uudelleen. Huomaat, että oikeanpuoleinen vesimolekyyli luovutti vetyatomin ytimen eli protonin H+ vasemmanpuoleiselle vesimolekyylille jättäen kuitenkin tämän vetyatomin elektronin itselleen. Näin sille jäi yksi happi- ja yksi vetyatomi, mutta samalla sillä on yksi “ylimääräinen” elektroni. Sen varaus on siis -1. Tämä ioni on nimeltään hydroksidi-ioni ja sen kemiallinen kaava on OH-.
Vasemmanpuoleinen vesimolekyyli otti vastaan yhden “ylimääräisen” protonin, joten sen varaus on +1. Tämä ioni on nimeltään oksonium-ioni ja sen kemiallinen kaava on H3O+.
[[$ 2\text{H}_2\text{O} \rightarrow \text{H}_3\text{O}^+ + \text{OH}^- $]]

Huomaa myös, että ioni voi koostua kahdesta tai useammasta joko saman tai eri alkuaineen atomeista, jotka ovat sitoutuneet molekyylisidoksin toisiinsa. Näitä kutsutaan moniatomisiksi ioneiksi.
Siis mitä tässä oikein tapahtui? Katsopa video uudelleen. Huomaat, että oikeanpuoleinen vesimolekyyli luovutti vetyatomin ytimen eli protonin H+ vasemmanpuoleiselle vesimolekyylille jättäen kuitenkin tämän vetyatomin elektronin itselleen. Näin sille jäi yksi happi- ja yksi vetyatomi, mutta samalla sillä on yksi “ylimääräinen” elektroni. Sen varaus on siis -1. Tämä ioni on nimeltään hydroksidi-ioni ja sen kemiallinen kaava on OH-.
Vasemmanpuoleinen vesimolekyyli otti vastaan yhden “ylimääräisen” protonin, joten sen varaus on +1. Tämä ioni on nimeltään oksonium-ioni ja sen kemiallinen kaava on H3O+.
Vetykloridi + vesi
[[$ \text{HCl} + \text{H}_2\text{O} \rightarrow \text{H}_3\text{O}^+ + \text{Cl}^- $]]
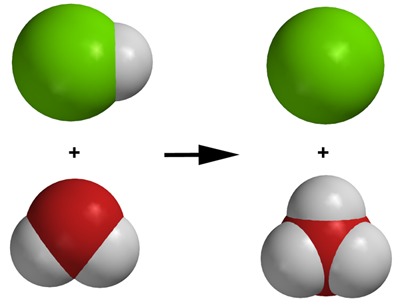
Tässäkin tapauksessa vetyatomin ydin eli protoni H+ vaihtoi omistajaa. Oikeanpuoleinen vetykloridimolekyyli luovutti protonin vasemmanpuoleiselle vesimolekyylille jättäen vetyatomin elektronin itselleen. Näin siihen jäi vain yksi klooriatomi, jolla on yksi “ylimääräinen” elektroni. Sen varaus on -1. Tämä on kloridi-ioni Cl-, joka on tuttu jo ruokasuolan yhteydestä.
Vasemmanpuoleinen vesimolekyyli otti vastaan yhden “ylimääräisen” protonin, joten sen varaus on +1 ja näin muodostui oksonium-ioni H3O+.

Tässäkin tapauksessa vetyatomin ydin eli protoni H+ vaihtoi omistajaa. Oikeanpuoleinen vetykloridimolekyyli luovutti protonin vasemmanpuoleiselle vesimolekyylille jättäen vetyatomin elektronin itselleen. Näin siihen jäi vain yksi klooriatomi, jolla on yksi “ylimääräinen” elektroni. Sen varaus on -1. Tämä on kloridi-ioni Cl-, joka on tuttu jo ruokasuolan yhteydestä.
Vasemmanpuoleinen vesimolekyyli otti vastaan yhden “ylimääräisen” protonin, joten sen varaus on +1 ja näin muodostui oksonium-ioni H3O+.
Ammoniakki + vesi
[[$ \text{NH}_3 + \text{H}_2\text{O} \rightarrow \text{NH}_4 \hspace{0.1 mm} ^+ + \text{OH}^- $]]
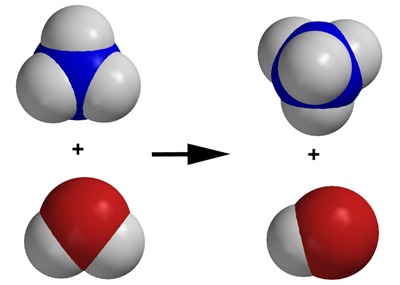
Oikeanpuoleinen vesimolekyyli luovutti protonin vasemmanpuoleiselle ammoniakkimolekyylille jättäen vetyatomin elektronin itselleen. Näin siihen jäi yksi happi- ja yksi vetyatomi ja yksi “ylimääräinen” elektroni eli siitä tuli hydroksidi-ioni OH-.
Vasemmanpuoleinen ammoniakkimolekyyli otti vastaan yhden “ylimääräisen” protonin, joten sen varaus on +1 ja näin muodostui ammonium-ioni NH4+.

Oikeanpuoleinen vesimolekyyli luovutti protonin vasemmanpuoleiselle ammoniakkimolekyylille jättäen vetyatomin elektronin itselleen. Näin siihen jäi yksi happi- ja yksi vetyatomi ja yksi “ylimääräinen” elektroni eli siitä tuli hydroksidi-ioni OH-.
Vasemmanpuoleinen ammoniakkimolekyyli otti vastaan yhden “ylimääräisen” protonin, joten sen varaus on +1 ja näin muodostui ammonium-ioni NH4+.