12. Alkoholit
Alkoholeja on monenlaisia
Kun arkielämässä puhutaan alkoholista, viitataan sillä yleensä vain yhteen yhdisteeseen, etanoliin. Tätä käsitystä on syytä laventaa, sillä alkoholit on kokonainen laaja orgaanisen kemian yhdisteryhmä. Alkoholiryhmään sisältyy suuri määrä erilaisia molekyylejä ja niillä on yksi yhteinen rakenteellinen ominaisuus:
Kun hiilivetymolekyylistä korvataan yksi tai useampi vetyatomi happiatomilla johon edelleen on liittynyt vetyatomi, kutsutaan tätä hapen ja vedyn muodostamaa hiilirunkoon sitoutunutta atomiryhmää hydroksyyliryhmäksi -OH. Hydroksyyliryhmä tekee molekyylistä alkoholin.
Alkoholit on ensimmäinen tässä oppikirjassa esitelty orgaaninen yhdisteryhmä, jossa hiilen ja vedyn lisäksi on kolmantena alkuaineena happi. Alkoholeissa on yleensä vain yksinkertaisia sidoksia.
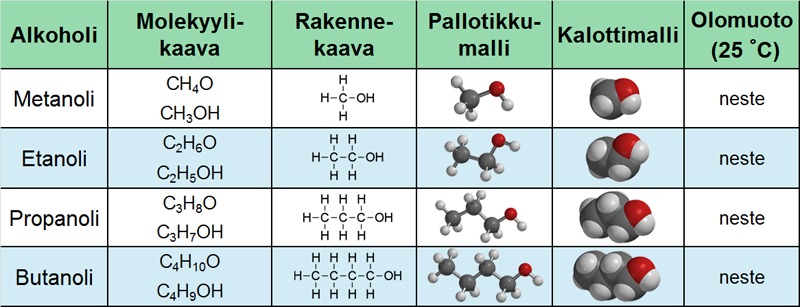
Alkoholit joissa on vain yksi hydroksyyliryhmä hiiliketjun päähän sitoutuneena, nimetään alkuosaltaan samoin kuin muut hiilivedyt. Nimen loppuosaan liitetään pääte -anoli:
Alkoholit on ensimmäinen tässä oppikirjassa esitelty orgaaninen yhdisteryhmä, jossa hiilen ja vedyn lisäksi on kolmantena alkuaineena happi. Alkoholeissa on yleensä vain yksinkertaisia sidoksia.
Alkoholit joissa on vain yksi hydroksyyliryhmä hiiliketjun päähän sitoutuneena, nimetään alkuosaltaan samoin kuin muut hiilivedyt. Nimen loppuosaan liitetään pääte -anoli:
- metanoli CH3OH,
- etanoli C2H5OH (tai CH3CH2OH),
- propanoli C3H7OH (tai CH3CH2CH2OH)
- jne...
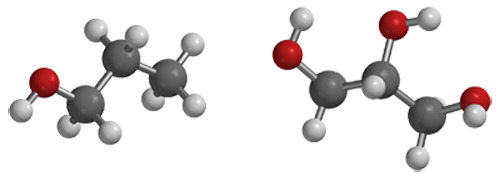
Vasemmalla propanoli ja oikealla glyseroli.
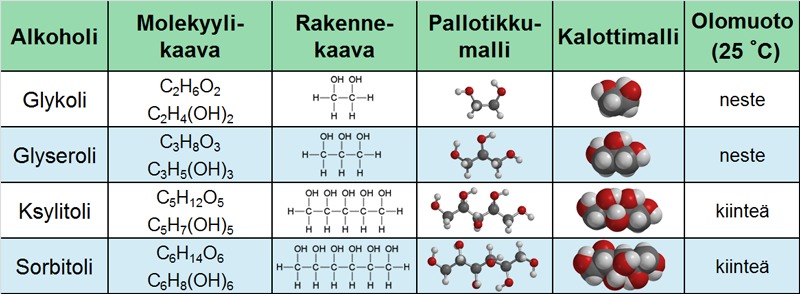
Glyseroli on moniarvoinen alkoholi, koska siinä on useampi hydroksyyliryhmä samassa molekyylissä. Moniarvoiset alkoholit nimetään totutusta tavasta poikkeavasti.
Kansainvälisesti on sovittu, että jokaisella molekyylillä olisi vain yksi ainutkertainen tietyin säännöin muodostettu systemaattinen nimi. Systemaattisen nimen lisäksi monille yhdisteille on ollut tarvetta antaa esimerkiksi kaupallinen nimi tai sitten niillä voi olla vaikka jokin historiallinen nimi. Useista yhdisteistä käytetäänkin rinnakkain systemaattista, kaupallista tai historiasta juontuvaa nimeä. Esimerkiksi glyserolin systemaattinen nimi on propaani-1,2,3-trioli.
Taulukko. Yksiarvoisia alkoholeja.
Taulukko. Moniarvoisia alkoholeja.
Alkaanien ja alkoholien ominaisuuksien vertailua
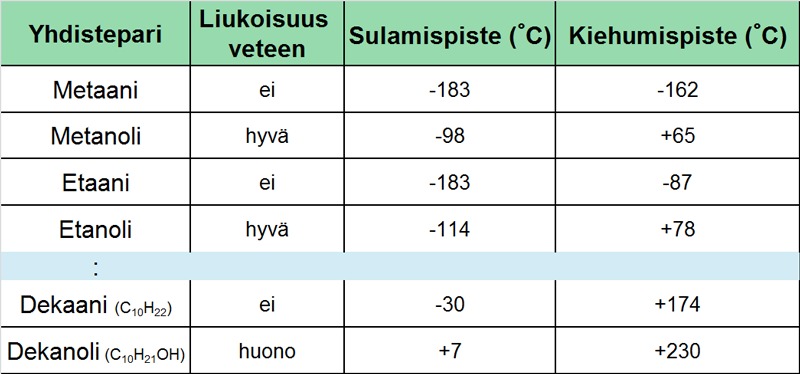
Taulukko. Alkaanien ja yksiarvoisten alkoholien ominaisuuksien vertailua.
Kun taulukon pienikokoisia alkaaneja ja alkoholeja verrataan keskenään havaitaan, että niiden ominaisuuksissa on suuria eroja. Alkaanit eivät liukene veteen, mutta alkoholit liukenevat. Alkaanien sulamis- ja kiehumispisteet ovat huomattavan paljon alhaisempia kuin vastaavien alkoholien. Mutta kun alkoholin hiiliketjuun lisätään pituutta, sen ominaisuudet lähenevät vastaavan alkaanin ominaisuuksia.
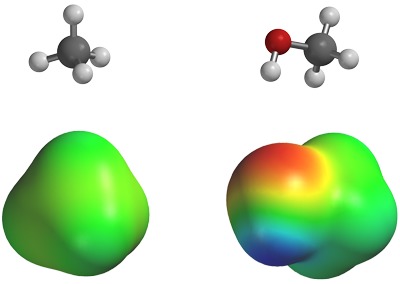
Vaikka molekyyli kokonaisuudessaan on neutraali, sähkövaraukset (+ ja -) jakautuvat molekyylin sisällä epätasaisesti. Tätä ilmiötä kutsutaan polarisaatioksi. Happiatomilla on taipumus vetää molekyylinsä elektroneja puoleensa voimakkaammin kuin molekyylin muut atomit. Niinpä sen ympärillä elektronitiheys on suurempi kuin muualla molekyylissä. Happiatomin puolella on siis pieni negatiivinen varaus ja muualla molekyylissä pieni positiivinen varaus.
Vaikka molekyyli kokonaisuudessaan on neutraali, sähkövaraukset (+ ja -) jakautuvat molekyylin sisällä epätasaisesti. Tätä ilmiötä kutsutaan polarisaatioksi. Happiatomilla on taipumus vetää molekyylinsä elektroneja puoleensa voimakkaammin kuin molekyylin muut atomit. Niinpä sen ympärillä elektronitiheys on suurempi kuin muualla molekyylissä. Happiatomin puolella on siis pieni negatiivinen varaus ja muualla molekyylissä pieni positiivinen varaus.
Sähkövarausten epätasainen jakautuminen molekyylin sisällä synnyttää kahden eri molekyylin välille kemiallisen sidoksen. Toisen molekyylin negatiivinen puoli ja toisen molekyylin positiivinen puoli vetävät toisiaan puoleensa. Tämä sidos on toki paljon heikompi kuin molekyylien sisäiset atomien väliset sidokset.
Koska pienillä alkoholimolekyyleillä polarisaatio on voimakasta, niiden molekyylit ovat tiukemmin kiinni toisissaan. Tämän vuoksi niiden sulattamiseen ja höyrystämiseen tarvitaan enemmän lämpöä, minkä seurauksena niiden sulamis- ja kiehumispisteet ovat huomattavasti korkeammat kuin vastaavilla alkaaneilla. Huomataan, että aineiden fysikaalisille muutoksille, kuten esimerkiksi olomuodon muutoksille, löytyy myös kemiallisia tekijöitä. Sama ilmiö on syynä niiden vesiliukoisuuteen.
Video alkoholien erilaisista ominaisuuksista.
Alkoholit luonnossa
 Etanolia syntyy luonnossa sokereista mikrobien aineenvaihduntatuotteena. Tätä vähähappisissa olosuhteissa tapahtuvaa biologista prosessia kutsutaan käymiseksi. Ylikypsissä marjoissa ja hedelmissä käymisreaktio pääsee tapahtumaan ja ne sisältävät hiukan etanolia.
Etanolia syntyy luonnossa sokereista mikrobien aineenvaihduntatuotteena. Tätä vähähappisissa olosuhteissa tapahtuvaa biologista prosessia kutsutaan käymiseksi. Ylikypsissä marjoissa ja hedelmissä käymisreaktio pääsee tapahtumaan ja ne sisältävät hiukan etanolia.Käymisprosesseissa voi syntyä myös vähäisiä määriä muita pienimolekyylisiä alkoholeja kuten metanolia, propanolia ja butanolia.
Selkärangattomat eläimet valmistavat soluissaan glyserolia kestääkseen paremmin pakkasta. Ksylitolia ja sorbitolia esiintyy myös luonnossa pieniä määriä marjoissa ja hedelmissä.
Alkoholien valmistus ja käyttö teollisuudessa
Suurien alkoholimäärien valmistaminen teollisessa mitassa tapahtuu joko biologisesti käymisprosessin ja sen jälkeisten erotusmenetelmien avulla tai synteettisiä valmistusmenetelmiä käyttäen. Jälkimmäinen tarkoittaa esimerkiksi metanolin valmistusta häkäkaasusta ja vedystä tai etanolin valmistusta eteenistä ja vedestä.
Pienimolekyylisten alkoholien käyttö teollisuudessa voidaan karkeasti jakaa kolmeen luokkaan:
Pienimolekyylisten alkoholien käyttö teollisuudessa voidaan karkeasti jakaa kolmeen luokkaan:
1. Polttoaineina
Alkoholien palaessa syntyy hiilidioksidia ja vettä. Eli siis samat tuotteet kuin hiilivetyjä poltettaessa.
Kun polttoaineena käytettävä etanoli on valmistettu käymisen avulla, sitä kutsutaan bioetanoliksi. Bioetanolia voidaan lisätä bensiinin sekaan korvaamaan fossiilisia hiilivetyjä.
Ongelmana on, että yhä suurempi osa esimerkiksi maailman sokeriruokoviljelmistä on valjastettu elintarviketuotannon sijasta bioetanolin tuotantoon.
Metanoli on myös hyvä polttoaine, mutta sen käyttöä rajoittaa voimakas myrkyllisyys.
Kun polttoaineena käytettävä etanoli on valmistettu käymisen avulla, sitä kutsutaan bioetanoliksi. Bioetanolia voidaan lisätä bensiinin sekaan korvaamaan fossiilisia hiilivetyjä.
Ongelmana on, että yhä suurempi osa esimerkiksi maailman sokeriruokoviljelmistä on valjastettu elintarviketuotannon sijasta bioetanolin tuotantoon.
Metanoli on myös hyvä polttoaine, mutta sen käyttöä rajoittaa voimakas myrkyllisyys.
2. Liuottimina, puhdistus- ja desinfiointiaineina
Alkoholit ovat tehokkaita liuottimia, jotka liuottavat monia vesiliukoisia ja veteen liukenemattomia yhdisteitä. Liuottimet voidaan jakaa kahteen ääripäähän, veteen ja hiilivetyihin (esimerkiksi bensiini). Alkoholit ovat liuottimina näiden kahden ääripään välissä.
Monissa nestemäisissä lääkkeissä etanoli toimii liuottimena, johon varsinainen lääkeaine on liuotettu. Lääkeaine saattaa olla veteen liukenematon, mutta toinen syy vahvan etanolin eli spriin käyttöön on sen desinfioiva (mikrobeja tappava) vaikutus.
Monissa nestemäisissä lääkkeissä etanoli toimii liuottimena, johon varsinainen lääkeaine on liuotettu. Lääkeaine saattaa olla veteen liukenematon, mutta toinen syy vahvan etanolin eli spriin käyttöön on sen desinfioiva (mikrobeja tappava) vaikutus.
3. Raaka-aineina muiden kemikaalien valmistuksessa
Alkoholit toimivat lähtöaineina monissa kemian teollisuuden prosesseissa, joissa valmistetaan muita orgaanisia molekyylejä.
Alkoholin matka pellolta polttoaineeksi
Orgaanisten molekyylien toiminnalliset eli funktionaaliset ryhmät
Palataanpa hiilivetyihin ja niistä erityisesti alkaaneihin. Alkaaneissa esiintyy vain hiili- ja vetyatomeja, ja niiden kaikki sidokset ovat yksinkertaisia sidoksia. Tarkastellaan näitä molekyylejä verrokkeina, joiden rakenteeseen tehtävä kemiallinen muutos tuottaa uudenlaisia, muihin yhdisteryhmiin kuuluvia molekyylejä:
Happiatomi O voi sitoutua hiiliatomiin C myös kahdella molekyylisidoksella eli kaksoissidoksella. Jos happi on sitoutunut tällä tavalla hiiliketjun päässä olevaan hiiliatomiin, orgaaninen yhdiste kuuluu aldehydeihin. Samaan hiiliatomiin voi vielä sitoutua hydroksyyliryhmä -OH, jolloin yhdiste kuuluu karboksyylihappoihin. Karboksyylihappoihin tutustutaan tarkemmin seuraavassa luvussa.
- Hiilirungossa voi olla yksi kaksoissidos hiiliatomien välillä: C=C (alkeenit)
- Hiilirungossa voi olla yksi kolmoissidos hiiliatomien välillä: C≡C (alkyynit)
- Yhteen tai useampaan hiiliatomiin voi olla sitoutuneena hydroksyyliryhmä: –OH (alkoholit)
Happiatomi O voi sitoutua hiiliatomiin C myös kahdella molekyylisidoksella eli kaksoissidoksella. Jos happi on sitoutunut tällä tavalla hiiliketjun päässä olevaan hiiliatomiin, orgaaninen yhdiste kuuluu aldehydeihin. Samaan hiiliatomiin voi vielä sitoutua hydroksyyliryhmä -OH, jolloin yhdiste kuuluu karboksyylihappoihin. Karboksyylihappoihin tutustutaan tarkemmin seuraavassa luvussa.