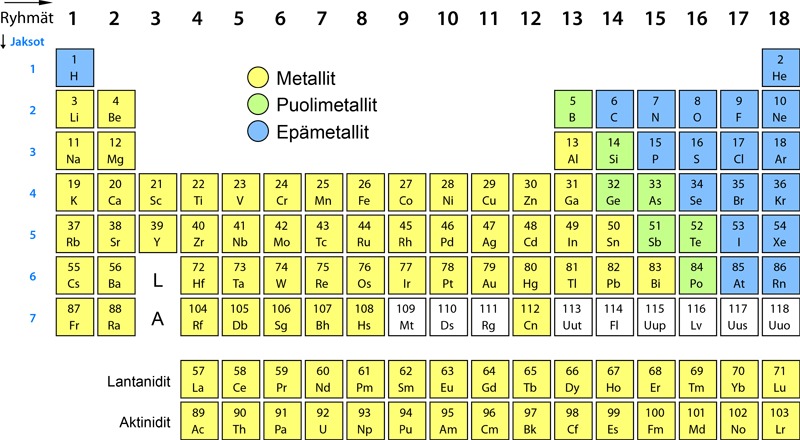
6. Alkuaineet taulukoksi
Jaksollisen järjestelmän keksiminen
Tätä palapeliä yritettiin koota monella tavalla, kunnes venäläinen kemisti Dimitri Mendelejev 1800-luvun puolivälin jälkeen ymmärsi jättää tyhjiä aukkoja omaan järjestelmäänsä. Hän ennusti, että aukot kuuluvat alkuaineille joita ei vielä ollut löydetty, mutta tullaan löytämään myöhemmin. Lopulta tyhjät paikat saatiin täytettyä mikä osoitti, että Mendelejev oli oikeassa.

Jaksollinen järjestelmä on edelleen käytössä, vaikka Mendelejevin aikaan mittaukset suoritettiin hämyisissä laboratorioissa paljon nykyajan laitteita ja kokeita alkeellisimmilla menetelmillä. Myöskään atomin rakennetta ei silloin vielä tunnettu. Vuosisatojen aikana taulukkoa on täydennetty ja täsmennetty uusien tutkimustulosten myötä. Näin tiede toimii.
Alkuaineen järjestysluku Z on merkitty alkuaineen merkin yläpuolelle. Sekä pysty- että vaakarivit ovat numeroitu. Pystyrivejä on 18 ja niitä kutsutaan ryhmiksi, vaakarivejä puolestaan on 7 ja niitä kutsutaan jaksoiksi. Pystyrivejä 1, 2, 13, 14, 15, 16, 17 ja 18 kutsutaan pääryhmiksi, pystyrivejä 3 - 12 sivuryhmiksi.
Atomi koostuu protoneista, neutroneista ja elektroneista
Aikaisemmista kemian opinnoistasi tiedät, että atomi koostuu kolmenlaisista hiukkasista:
-
Positiivisesti varautuneista protoneista, jotka sijaitsevat atomin ytimessä. Protonien lukumäärä on sama kuin alkuaineen järjestysluku.
-
Sähköisesti neutraaleista neutroneista, jotka sijaitsevat myös atomin ytimessä.
-
Negatiivisesti varautuneista elektroneista, jotka sijaitsevat ytimen ympärillä.
Kuorimallin piirtäminen
-
Piirrä ytimen ympärille isompi ympyrä. Tämä on 1. kuori eli sisin elektronikuori. Tälle kuorelle mahtuu 2 elektronia. Merkitse ne tälle ympyrälle vaikkapa pieninä mustina palloina.
-
Jos elektroneja on vielä jäljelle, piirrä uusi ympyrä isommalla säteellä ytimen ympärille. Tämä on 2. kuori ja sille mahtuu 8 elektronia. Merkitse elektronit tälle kuorelle.
-
Mikäli elektroneja on vielä jäljelle, piirrä taas uusi ympyrä isommalla säteellä. Tämä on 3. kuori jolle mahtuu 18 elektronia. Täytä kuori elektroneilla.
Kuorimallin heikkous
 Entäpä alkuaine numero 19, kalium K? Koska sen järjestysluku on 19, sillä on 19 elektronia. Elektroneista 2 menee 1. kuorelle ja 8 2. kuorelle. Jäljelle jää 9 elektronia, jotka mahtuisivat helposti 3. kuorelle, mutta todellisuudessa 3. kuorelle sijoittuu näistä kahdeksan ja yksi seuraavalle eli 4. kuorelle.
Entäpä alkuaine numero 19, kalium K? Koska sen järjestysluku on 19, sillä on 19 elektronia. Elektroneista 2 menee 1. kuorelle ja 8 2. kuorelle. Jäljelle jää 9 elektronia, jotka mahtuisivat helposti 3. kuorelle, mutta todellisuudessa 3. kuorelle sijoittuu näistä kahdeksan ja yksi seuraavalle eli 4. kuorelle.Viimeistä kuorta jolle riittää elektroneja, kutsutaan uloimmaksi kuoreksi. Tällä kuorella sijaitsevia elektroneja kutsutaan ulkoelektroneiksi. Uloimman kuoren elektronimiehitys kertoo hyvin paljon kyseisen alkuaineen kemiallisista ominaisuuksista. Siihen täytyy kiinnittää erityistä huomiota silloin, kun pyritään ymmärtämään jotakin kemian ilmiötä atomitasolla.
Atomin uloimmalla kuorella voi olla korkeintaan kahdeksan elektronia. Mikäli uloimmalla kuorella on tasan kahdeksan elektronia, sitä kutsutaan oktettirakenteeksi eli oktetiksi. Tällainen elektronirakenne on hyvin pysyvä.
Verkkotehtävä: Elektronikuorten elektronimäärien esittäminen
- miten jaksollisessa järjestelmässä esitetään elektronikuorten elektronimäärät.
- millä alkuaineilla on oktettirakenne.