29.4.2020 - Seoslaskut
Seoslaskut kannattaa jakaa kahteen erilaiseen tapaukseen. Tuotetta syntyy yhdestä lähtöaineesta ja tuotetta syntyy useammasta lähtöaineesta.
Ensimmäisessä tapauksessa riittää tehdä reaktioyhtälö tuotteen muodostumisesta ja ratkaista lähtöaineen määrä tämän perusteella. Jos reaktioyhtälön muodostaminen ei onnistu, voidaan stoikiometriset kertoimet tuotteelle ja lähtöaineelle päätellä myös ilman reaktioyhtälöä.
Jos tuotetta syntyy useammasta lähtöaineesta (käytännössä kahdesta), on tehtävä reaktioyhtälö erikseen jokaiselle lähtöaineelle. Tämän jälkeen valitaan muuttujat ja ratkaistaan lähtöaineiden määrät. Esimerkkeinä kummatkin tapaukset.
3.8 Kiinteä hopeanitraatti sisälsi epäpuhtautena natriumnitraattia. Kun 3,012 grammaa tätä seosta liuotettiin veteen ja seokseen lisättiin ylimäärin natriumkloridiliuosta, hopeaionit saostuivat hopeakloridina. Kun saostuma suodatettiin, kuivattiin ja punnittiin, sen massaksi saatiin 2,466 g. Mikä oli epäpuhtautena olevan natriumnitraatin osuus massaprosentteina?

3.12 Metalliseos sisältää sinkkiä ja alumiinia, jotka reagoivat happojen kanssa vetykaasua vapauttaen. Kun metalliseoksesta otettiin 1,00 g:n näyte ja sen annettiin reagoida rikkihapon kanssa, vapautui 84,0 milligrammaa vetykaasua. Kuinka monta grammaa alumiinia oli seoksessa?
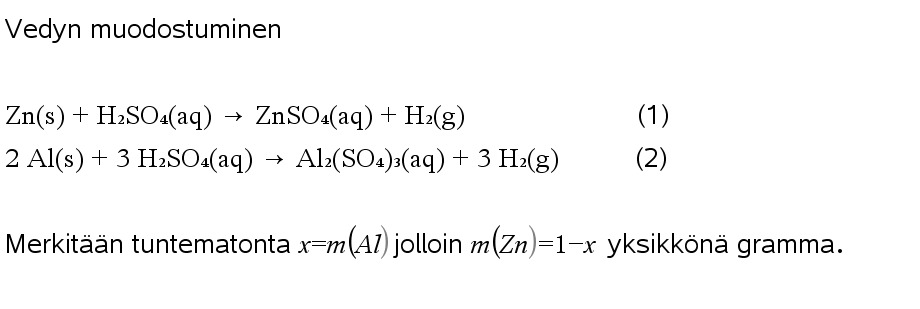

Harjoitukset melko vaativia 3.9 (palautettava, olkoon palautusaika tämän viikon loppuun kun on vappu ja kaikkea) ja 3.13.
Ohjeita: Tehtävässä 3.9 voi olla hankala muodostaa reaktioyhtälöä mutta siitä voi selvitä ilmankin. Tehdään ensin malli tilanteesta

Sitten aletaan purkamaan lopusta alkuun päin. Ensin muodosta neutraloitumisreaktion yhtälö ja laske suolahapon kulutuksen perusteella ammoniakin ainemäärä. Päättele sitten ammoniakin ja ammoniumsulfaatin ainemäärien suhde ja ratkaise kuinka paljon näytteessä oli ammoniumsulfaattia. Muuta massaksi ja vastaa kysymykseen.
Ohje 3.13: tulos oli muistaakseni väärin kirjassa. Saatko 2,04457g.
Opetus.tv:n video: https://opetus.tv/kemia/ke3/seoslasku/
Ensimmäisessä tapauksessa riittää tehdä reaktioyhtälö tuotteen muodostumisesta ja ratkaista lähtöaineen määrä tämän perusteella. Jos reaktioyhtälön muodostaminen ei onnistu, voidaan stoikiometriset kertoimet tuotteelle ja lähtöaineelle päätellä myös ilman reaktioyhtälöä.
Jos tuotetta syntyy useammasta lähtöaineesta (käytännössä kahdesta), on tehtävä reaktioyhtälö erikseen jokaiselle lähtöaineelle. Tämän jälkeen valitaan muuttujat ja ratkaistaan lähtöaineiden määrät. Esimerkkeinä kummatkin tapaukset.
3.8 Kiinteä hopeanitraatti sisälsi epäpuhtautena natriumnitraattia. Kun 3,012 grammaa tätä seosta liuotettiin veteen ja seokseen lisättiin ylimäärin natriumkloridiliuosta, hopeaionit saostuivat hopeakloridina. Kun saostuma suodatettiin, kuivattiin ja punnittiin, sen massaksi saatiin 2,466 g. Mikä oli epäpuhtautena olevan natriumnitraatin osuus massaprosentteina?

3.12 Metalliseos sisältää sinkkiä ja alumiinia, jotka reagoivat happojen kanssa vetykaasua vapauttaen. Kun metalliseoksesta otettiin 1,00 g:n näyte ja sen annettiin reagoida rikkihapon kanssa, vapautui 84,0 milligrammaa vetykaasua. Kuinka monta grammaa alumiinia oli seoksessa?
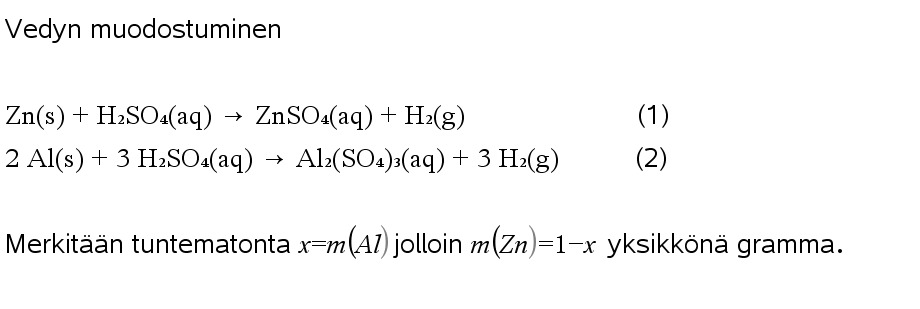

Harjoitukset melko vaativia 3.9 (palautettava, olkoon palautusaika tämän viikon loppuun kun on vappu ja kaikkea) ja 3.13.
Ohjeita: Tehtävässä 3.9 voi olla hankala muodostaa reaktioyhtälöä mutta siitä voi selvitä ilmankin. Tehdään ensin malli tilanteesta

Sitten aletaan purkamaan lopusta alkuun päin. Ensin muodosta neutraloitumisreaktion yhtälö ja laske suolahapon kulutuksen perusteella ammoniakin ainemäärä. Päättele sitten ammoniakin ja ammoniumsulfaatin ainemäärien suhde ja ratkaise kuinka paljon näytteessä oli ammoniumsulfaattia. Muuta massaksi ja vastaa kysymykseen.
Ohje 3.13: tulos oli muistaakseni väärin kirjassa. Saatko 2,04457g.
Opetus.tv:n video: https://opetus.tv/kemia/ke3/seoslasku/