Periodiska systemet och bindningar Åk8
GRUNDÄMNEN OCH ATOMER
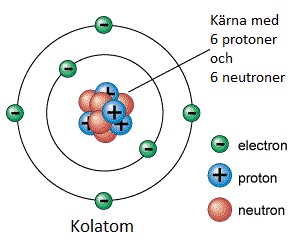
Fakta om atomen
- I atomens kärna finns positivt (+) laddade protoner och neutrala neutroner.
- Runt kärnan i elektronhöljet rör sig negativt (-) laddade elektroner.
- Atomens atomnummer (ordningstal) = antalet protoner.
- Atomen har ingen laddning utåt eftersom: antalet protoner = antalet elektroner.
Atomen (video av Andreas Sandqvist)
Elektronskal
- Elektronerna rör sig inte runt kärnan hur som helst utan de finns i elektronskal.
- En elektron placerar sig i ett elektronskal så nära kärnan som möjligt.
- Elektronerna i det yttersta skalet kallas ytterelektroner eller valenselektroner.
- Antalet elektroner i det yttersta skalet bestämmer atomens egenskaper.
- Följande regler gäller för elektronskalen:
|
Skalets nummer |
Max elektroner |
Max elektroner |
|
1 (K-skal) |
2 |
2 |
|
2 (L-skal) |
8 |
8 |
|
3 (M-skal) |
18 |
8 |
|
4 (N-skal) |
32 |
8 |
|
n |
2n2 |
8 |
Bygg atomer (simulering från PhET)
Fakta om grundämnen
- Det finns 118 grundämnen.
- Alla atomer tillhör något grundämne.
- Ett grundämne kan inte sönderdelas kemiskt till nya ämnen.
- Alla atomer som tillhör samma grundämne har lika många protoner.
Förhör
PERIODISKA SYSTEMET

Periodiska systemet består av grupper och perioder.
Grupper
- Lodräta kolumner i periodiska systemet kallas grupper (1,2,……,17,18)
- Grupperna 1,2,13,14,15,16,17 och 18 kallas huvudgrupper.
- Grupperna 3,4,.....,12 kallas undergrupper.
- Grundämnena i samma huvudgrupp har atomer med lika många ytterelektroner (valenselektroner).
- Eftersom antalet ytterelektroner bestämmer grundämnets kemiska egenskaper, har ämnen i samma huvudgrupp likartade kemiska egenskaper.
Perioder
- Vågräta rader i periodiska systemet kallas perioder (1,2,3,4,5,6,7)
- Grundämnen i samma period har atomer med valenselektroner i samma skal.
Periodiska systemets uppbyggnad (video av Magnus Ehinger)
Atomen och det periodiska systemet (elevspel.se)
Förhör
ATOMEN BLIR JON
ATOM
En atom saknar laddning eftersom antalet protoner (+) och antalet elektroner (-) är lika till antalet.
OKTETTREGELN
- Atomer i huvudgrupperna vill ha 8 ytterelektroner (full oktett).
- Atomerna vill ha ädelgasstruktur, d.v.s. samma elektronstruktur som ädelgaserna i grupp 18. (Atomer med få elektroner vill ha 2 ytterelektroner d.v.s. samma elektronstruktur som ädelgasen helium)
JON
- En atom kan ta emot eller ge bort elektroner för att få full oktett och atomen blir då till en jon.
- En jon har positiv eller negativ laddning eftersom antalet protoner och elektroner är olika.
- En atom och en jon av samma grundämen har lika många protoner, men antalet elektroner är olika.
Positiv jon
- En atom omvandlas till en positiv jon när den avger minst en elektron.
- En postitv jon har flera protoner än elektroner.
- Postiva joner bildas främnst av grundämnena i huvudgrupperna 1,2 och 13 samt av metallerna i undergrupperna.
Na -> Na+ + e-
Ca -> Ca2+ + 2e-
Al -> Al3+ + 3e-
Zn -> Si2+ + 2e-
Negativ jon
- En atom omvandlas till en negativ jon när den tar emot minst en elektron.
- En negativ jon har flera elektroner än protoner.
- Negativt laddade joner bildas främst av av grundämnen i huvudgrupperna 15, 16 och 17 (icke-metaller).
N + 3e- -> N3-
S + 2e- -> S2-
Br + e- -> Br-
Jonens laddning utgående från periodiska systemet
| 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| Na+ | Ca2+ | Al3+ | C4+ | N3- | O2- | Br- | Bildar inte joner |
| K+ | Mg2+ | B3+ | Si4+ | P3- | S2- | Cl- |
Ädelgaser (video av Magnus Ehinger)
Alkalimetaller och halogner (video av Magnus Ehinger)
Jordalkalimetaller och syregruppen (video av Magnus Ehinger)
Förhör
JONFÖRENINGAR
Kemiska bindningar
Atomer binds ihop med kemika bindningar.
Exempel på kemiska bindningar är:
- Jonbindningar
- Kovalenta bindningar
Kemisk bindningar (video av Fröken Ulle)
Jonföreningar
- Jonföreningar kallas även för salter.
- Jonföreningar bildas av en stor mängd positiva och negativa joner .
- Postiva och negativa joner binds till varandra med jonbidningar.
- Jonerna bildar en regelbunden kristallstruktur.
Namn och formel för jonföreningar (salter)
- Både i saltets namn och formel skriver man först den positva jonen och sedan den negativa jonen.
- Jonladdningar skrivs inte ut i formeln.
- Antalet joner uttrycks med en nedsänkt siffra som är det minsta möjliga heltal.
- Summan av laddningarna för jonerna i saltet är alltid noll.
Jonbindning
- Bindning mellan metaller och icke-metaller.
- Bindning mellan positiva och negativa joner som uppstår p.g.a. attraktion mellan olika laddade joner (+ och -).
Joner (video av Andreas Sandqvist)
Hur jonföreningar bildas (video av Magnus Ehinger)
Jonbindningar (video av Magnus Ehinger)
MOLEKYLER
Molekyl
- Molekylerna bildas vanligtvis av atomer som är icke-metaller.
- Grundämnesmolekyl innerhåller atomer av endast ett grundämen (t.ex. syremolekylen).
- I molekylföreningar finns det atomer av minst två olika grundämen (t.ex. vattenmolekylen).
- I en molekyl är atomerna sammanbundna med kovlenta bindningar.
Kovalent bindning
- Bindning mellan atomer som är icke-metaller.
- Atomer delar på elektroner för att få 8 ytterelektroner (full oktett)
- Enkelbindning om två atomer delar på 2 ytterelektroner, d.v.s. de har ett gemensamt elektronpar.
- Dubbelbindning om två atomer delar på 4 ytterelektroner, d.v.s. de har två gemensamma elektronpar.
- Trippelbindning om två atomer delar på 6 ytterelektroner, d.v.s. de har tre gemensamma elektronpar.
Kovalent bindning (video av Magnus Ehinger)