8. Sähkön avulla kemiaa – elektrolyysikenno
1. Elektrolyysissä sähkö saa aikaan kemiallisen reaktion

Hyvin pian kemiallisen sähkön keksimisen jälkeen sitä alettiin käyttää kemiallisten reaktioiden aiheuttamiseen. Tutkijat päättelivät, että jos kemialliset reaktiot voivat aikaansaada sähköä, niin sähköllä pitäisi myös voida saada aikaan kemiallisia reaktioita.
Kun tieto Voltan patsaasta tuli Englantiin vuoden 1800 tienoilla, William Nicholson (1753–1815) ja Anthony Carlisle (1768–1840) rakensivat muutamassa päivässä laitteen ja hajottivat sen avulla vettä vedyksi ja hapeksi. Sähkökemian aikakausi oli alkanut.
Michael Faradayta (1791–1867) (kuvassa) pidetään merkittävimpänä sähkökemian kehittäjänä. Hänen keksimiään sanoja ovat ionin, anioni, kationi, anodi, katodi, elektrolyytti (liuos) ja elektrolyysi (prosessi). Sana elektrolyysi tulee kreikan kielestä ja tarkoittaa sähkön hajottamista (kreik. elektron, sähkö; lysis, hajoittaa). Se tarkoittaa myös meripihkaa, siis ainetta, jossa sähköilmiöt ensin keksittiin.
Faraday osoitti, että liuoksessa sähkön kuljettajat olivat liuoksen hajaantumistuotteita. Nesteessä olevia liikkuvia varauksellisia hiukkasia hän nimitti ioneiksi. Se tulee kreikan kielestä ja tarkoittaa vaeltajaa. Anioni olisi siten luoksevaeltaja ja kationi poisvaeltaja. Anodiksi nimettiin se elektrodi, johon negatiivisesti varautuneet ionit vaelsivat, ja katodiksi puolestaan sitä elektrodia, johon positiivisesti varautuneet kationit kulkeutuivat. Elektrolyysikennossa anodi varautuu positiivisesti ja katodi negatiivisesti.

2. Sähkönjohteet
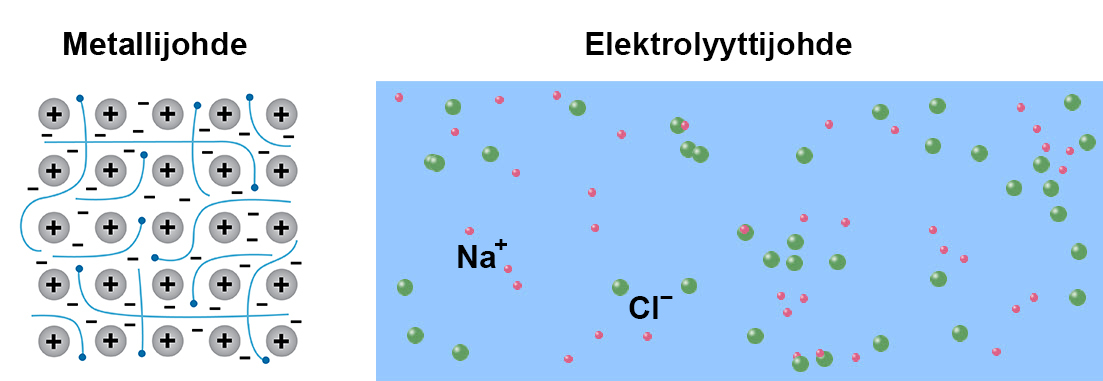
Sähkövirran kulku edellyttää liikkuvaa varausta. Useimmissa aineissa tällaisia vapaasti liikkuvia hiukkasia on niukasti ja niitä pidetään eristeinä. Sähköä hyvin johtavia aineita on kolmea lajia, metallijohteita, epämetallijohteita ja elektrolyyttijohteita.
Metallijohteiden luokkaan kuuluvat metallit ja epämetallijohteiden grafiitti. Grafiitti on yksi hiilen esiintymismuodoista. Muut ovat timantti ja fullereeni. Näissä aineissa sähkönjohtavuus perustuu liikkuviin elektroneihin ja sähkövirta on elektronien virtaa.
Elektrolyyttijohteita ovat suoloihin, happoihin, emäksiin kuuluvat aineet etenkin vesiliuoksina ja sulana. Elektrolyyttijohteissa sähköjohtavuus perustuu liikkuviin varauksellisiin ioneihin.
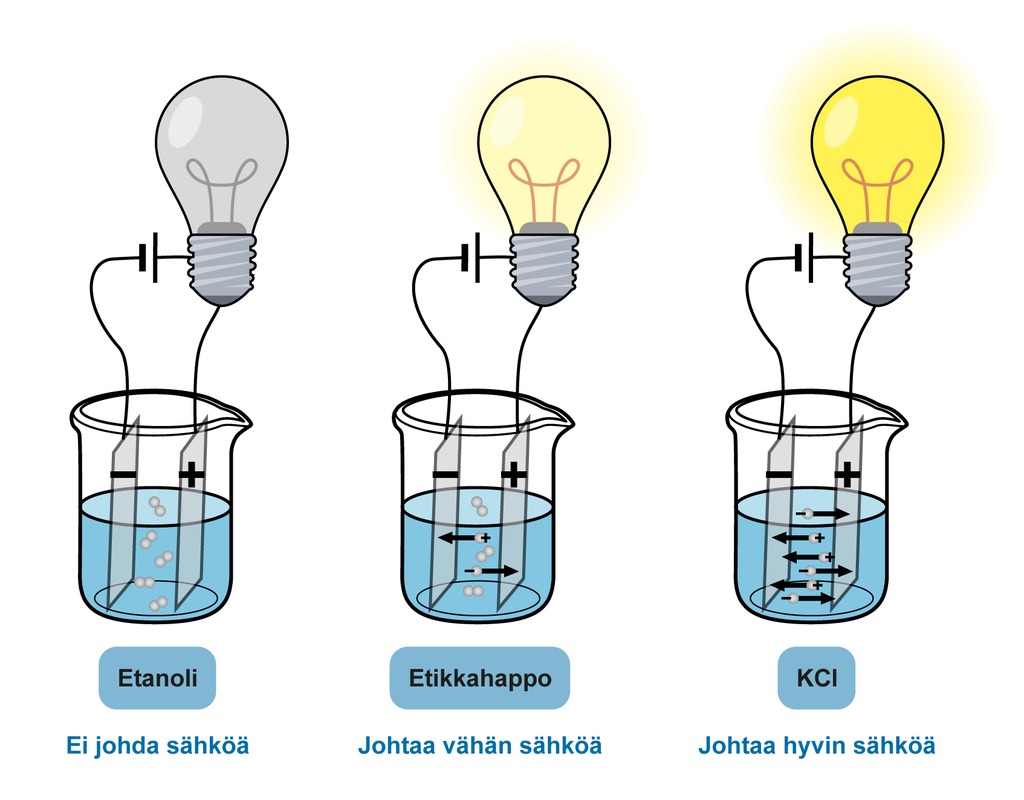
Elektrolyytin sähköjohtavuus riippuu siitä, miten paljon liuoksessa on varauksellisia hiukkasia. Alkoholissa on hyvin vähän varautuneita hiukkasia, joten liuos ei johda sähköä. Kaliumkloridin vesiliuoksessa on runsaasti kalium- (K+) ja kloridi (Cl−) -ioneja. Happojen vesiliuosten sähköjohtavuus vaihtelee sen mukaan, onko kyseessä vahva vai heikko happo. Vahva happo ionisoituu lähes täydellisesti ja johtaa paremmin kuin heikon hapon liuos, joka ionisoituu vain osittain.
3. Elektrolyysi saa aikaan kemiallisia reaktioita
 Elektrolyysissä sähköllä saadaan aikaan hapetus-pelkistysreaktioita. Jännitelähde voi olla paristo, akku tai verkkovirtaa käyttävä sähkölaite. Elektrodina käytetään jotain sähköä johtavaa materiaalia, kuten grafiittia tai metallia. Elektrodit voivat olla keskenään samaa ainetta tai eri ainetta. Olennaista on, että ulkoisen energian ansiosta liuoksessa saadaan tapahtumaan reaktioita, jotka eivät muuten tapahtuisi.
Elektrolyysissä sähköllä saadaan aikaan hapetus-pelkistysreaktioita. Jännitelähde voi olla paristo, akku tai verkkovirtaa käyttävä sähkölaite. Elektrodina käytetään jotain sähköä johtavaa materiaalia, kuten grafiittia tai metallia. Elektrodit voivat olla keskenään samaa ainetta tai eri ainetta. Olennaista on, että ulkoisen energian ansiosta liuoksessa saadaan tapahtumaan reaktioita, jotka eivät muuten tapahtuisi.
Elektrolyysilaitteistossa elektrodit on kytketty jännitelähteeseen, jonka syöttämien elektronien avulla pakotetaan kemialliset reaktiot tapahtumaan. Toinen elektrodeista kytketään positiviiseen napaan, toinen negatiiviseen. Positiiviseen napaan kytketty elektrodi varautuu positiivisesti, ja negatiiviseen napaan kytketty negatiivisesti. Liuoksessa olevat ionit liikkuvat sille elektrodille, jolla on erimerkkinen varaus kuin ionilla itsellään. Liikkeen saa aikaiseksi sähköinen vetovoima.
Kun positiivisesti varautunut ioni kohtaa negatiivisesti varautuneen elektrodin pinnan, se vastaanottaa elektroneja ja pelkistyy. Kun negatiivisesti varautunut ioni kohtaa positiivisesti varautuneen elektrodin pinnan, se luovuttaa elektroneja ja hapettuu. Esimerkiksi kuparikloridin (CuCl2) vesiliuosta elektrolysoitaessa kupari pelkistyy katodilla elektrodin pintaan metallisena kuparina. Anodilla kloridi-ionit (Cl-) luovuttavat elektronin elektrodille ja hapettuvat kloorikaasuksi (Cl2).
![]() Kuparikloridin elektrolyysi
Kuparikloridin elektrolyysi
4. Veden elektrolyysi
 Vesimolekyylit voidaan hajottaa sähkövirran avulla vety- ja happikaasuiksi (H2 ja O2). Negatiivisella elektrodilla (katodi) syntyy vetyä ja positiivisella (anodi) happea.
Vesimolekyylit voidaan hajottaa sähkövirran avulla vety- ja happikaasuiksi (H2 ja O2). Negatiivisella elektrodilla (katodi) syntyy vetyä ja positiivisella (anodi) happea.
[[$ 2 \thinspace \text{H}_2\text{O} \rightarrow 2 \thinspace \text{H}_2 + \text{O}_2 $]]
Veden elektrolyysi on yksi tapa tuottaa alkuainemuodossa olevaa vetyä puhtaaksi polttoaineeksi. Se on yksi elektrolyysin merkittävimmistä sovelluksista.