Syror, baser och salter Åk9
SURHET
pH anger surheten för en lösning
- pH i en neutral lösning är 7
- pH i en sur lösning är under 7
- pH i en baskisk lösning är över 7
- Med pH-papper kan man bestämma pH-värdet för en lösning.
- BTB och fenolftalein är indikatorer med vilka man kan avgör om en lösning är sur eller basisk utgående från färgen.
- BTB: gul = sur, grön=neutral, blå=basisk
- Fenolftalein: ingen färg=sur, lila färg =basisk
Sur lösning
- pH under 7
- innehåller oxoniumjoner H3O+
- sur smak
- pH över 7
- innehåller hydroxidjoner OH-
- sträv smak
- känns hala
pH skala (simulering från PhET)
Förhör
SYROR
| Formel | Namn |
| HCl | saltsyra (klorvätesyra) |
| HNO3 | salpetersyra |
| H2SO4 | svavelsyra |
| H2CO3 | kolsyra |
| H3PO4 | fosforsyra |
EXEMPEL PÅ ORGANISKA SYROR
| Formel | Namn |
| HCOOH | metansyra (myrsyra) |
| CH3COOH | etansyra (ättika) |
- Alla syror innehåller väte (H).
- Syra är ett ämne som kan avge vätejoner (H+)
VATTENLÖSNINGAR AV SYROR
vätejoner + vatten -> oxoniumjoner
H+ + H2O -> H3O+
2 H+ + 2 H2O -> 2 H3O+
3 H+ + 3 H2O -> 3 H3O+
Saltsyra
HCl + H2O -> H3O+ + Cl-
Saltsyra + vatten -> oxoniumjon + kloridjon
Salpetersyra
HNO3 + H2O -> H3O+ + NO3-
Salpetersyra + vatten -> oxoniumjon + nitratjon
Svavelsyra
H2SO4 + 2 H2O -> 2 H3O+ + SO42-
Svavelsyra + vatten - oxoniumjoner + sulfatjon
Kolsyra
H2CO3 + 2 H2O -> 2 H3O+ + CO32-
Kolsyra + vatten -> oxoniumjoner + karbonatjon
Fosforsyra
H3PO4 + 3 H2O -> 3 H3O+ + PO43-
Fosforsyra + vatten -> oxoniumjoner + fosfatjon
FAKTA OM SYROR
Oxoniumjoner (H3O+) som finns i alla vattenlösningar av syror gör att:
- pH mindre än 7 (pH skalan anger koncentrationen av oxoniumjoner)
- BTB får gul färg
- syror har sur smak
- vätgas bildas med oädla metaller t.ex. Zn och Mg
- vattenlösningar av syror leder elektricitet p.g.a. fritt rörliga joner
STARK OCH SVAG SYRA
- I en vattenlösning av en stark syra (t.ex. saltsyra) finns det just inga syramolekyler utan syramolekylerna har reagerat med vatten och blivit till joner.
- I en vattenlösning av en svag syra (t.ex. kolsyra) har endast en liten del av syramolekyler reagerat med vatten och blivit till joner.
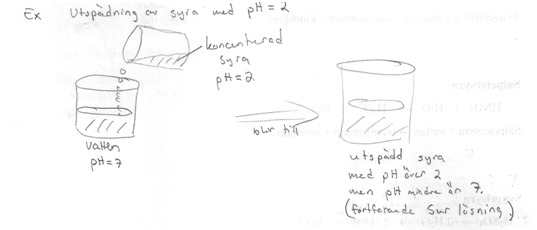
KONCENTRERAD OCH UTSPÄDD SYRA
- I en koncentrerad syra finns mycket syra och lite vatten.
- I en utspädd syra finns lite syra och mycket vatten.
UTSPÄDNING AV SYRA
- Regel vi utspädning: SIV = syra i vatten.
- Då en syra utspäds med vatten ökar pH värdet och blir närmare neutralt pH.
Obs! En sur lösning blir aldrig neutral eller basisk vid utspädning med vatten.
FRAMSTÄLLNING AV SYROR
Saltsyra
Vätgas och klorgas reagerar till saltsyra
H2 + Cl2 -> 2 HCl
Svavelsyra
Förbränning av svavel ger svaveldioxid
S + O2 -> SO2
Svaveldioxid oxideras till svaveltrioxid
2 SO2 + O2 -> 2 SO3
Svaveltrioxid och vatten blir till svavelsyra
SO3 + H2O -> H2SO4
Kolsyra
CO2 + H2O -> H2CO3
koldioxid + vatten -> kolsyra
Syror (video av Magnus Ehinger)
Förhör
BASER
| Formel | Namn |
| NaOH | natriumhydroxid |
| Ca(OH)2 | kalciumhydroxid |
| Al(OH)3 | aluminiumhydroxid |
VATTENLÖSNING AV BASISKA SALTER
NaOH -> Na+ + OH-
Ca(OH)2 -> Ca2+ + 2 OH-
Al(OH)3 -> Al3+ + 3 OH-
Basiska lösningar innehåller alltid hydroxidjoner (OH-)
AMMONIAK I VATTEN GER BASISK LÖSNING
NH3 + H2O -> NH4+ + OH-
NH3 är en bas eftersom den kan ta emot vätejon (H+)
H2O är en syra eftersom den kan ge bort vätejon (H+)
FAKTA OM BASISKA LÖSNINGAR
Hydroxidjoner (OH-) som finns i alla basiska vattenlösningar gör att:
- pH är större än 7
- BTB för blå färg
- fenolftalein får lila färg
- smaken är sträv
- lösningen leder elektricitet
Baser (video av Magnus Ehinger)
Syror och baser del 2 (video av Andreas Sandqvist)
Förhör
SALTER
FAKTA OM SALTER
- Salt är en jonförening
- Saltets namn börjar med namnet på den positiva jonen och slutar med namnet på den negativa jonen.
- I ett salt finns lika många positiva och negativa laddningar.
EXEMPEL PÅ SLATER
Natriumklorid
Na+ + Cl- -> NaCl
Magnesiumoxid
Mg2+ + O2- -> MgO
Kalciumklorid
Ca2+ + 2 Cl- -> CaCl2
Natriumoxid
2 Na+ + O2- -> Na2O
Aluminiumoxid
2 Al3+ + 3 O2- -> Al2O3
Kalciumsulfat
Ca2+ + SO42- -> CaSO4
Kaliumsulfat
2 K+ + SO42- -> K2SO4
Kalciumnitrat
Ca2+ + 2 NO3- -> Ca(NO3)2
Ammoniumfosfat
3 NH4+ + PO43- -> (NH4)3PO4
Kalciumfosfat
3 Ca2+ + 2 PO43- -> Ca3(PO4)2
Aluminiumsulfat
2 Al3+ + 3 SO42- -> Al2(SO4)3
FRAMSTÄLLNING AV SALTER
Salt från syra och bas
Syra + bas -> salt + vatten
Saltsyra och natriumhydroxid ger natriumklorid och vatten
HCl + NaOH -> NaCl + H2O
Salpetersyra och natriumhydroxid ger natriumnitrat och vatten
HNO3 + NaOH -> NaNO3 + H2O
Svavelsyra och kaliumhydroxid ger kaliumsulfat och vatten
H2SO4 + 2 KOH -> K2SO4 + 2 H2O
Salt från syra och metall
Syra + metall -> salt + vätgas
Svavelsyra och magnesium ger magnesiumsulfat och vätgas.
H2SO4 + Mg -> MgSO4 + H2
Saltsyra och magnesium ger magnesiumklorid och vätgas.
2 HCl + Mg -> MgCl2 + H2
Salpetersyra och magnesium ger magnesiumnitrat och vätgas.
2 HNO3 + Mg -> Mg(NO3 )2 + H2
Förhör
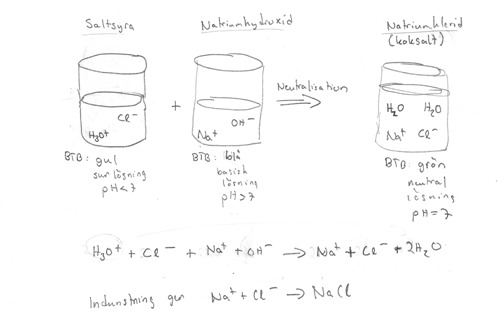
NEUTRALISATION
Om man blandar en sur lösning med en bask lösning i lämpliga proportioner blir lösningen neutral.
sur lösning + basisk lösning -> neutral lösning
pH mindre än 7 + pH över 7 -> pH lika med 7
H3O+ + OH- -> 2 H2O
Exempel Neutralisation av saltsyra med natriumhydroxid
Förhör
SUR OXID OCH BASISK OXID
Oxider
- I förbränningsreaktioner bildas oxider.
- metall + syre -> metalloxid
- icke-metall + syre -> icke metall-oxid
Metalloxider
- Metetalloxid är en förening mellan en metall och syre, t.ex. kalciumoxid CaO.
- Metalloxider i vatten ger basisk lösning.
Icke-metalloxid
- Icke-metalloxid är en förening mellan en icke-metall och syre.
- Icke-metalloxider i vatten oxider ger sur lösning.