9. Molekyylisidos
Johdanto
 Yksittäisessä atomissa elektronit muodostavat elektronipilven, joka on suuntautunut tasaisesti joka suuntaan ytimen ympärille. Tässä mielessä atomin pallomalli, niin yksinkertainen kuin se onkin, on oikea tapa mallintaa yksittäistä atomia.
Yksittäisessä atomissa elektronit muodostavat elektronipilven, joka on suuntautunut tasaisesti joka suuntaan ytimen ympärille. Tässä mielessä atomin pallomalli, niin yksinkertainen kuin se onkin, on oikea tapa mallintaa yksittäistä atomia.Entäpä jos meillä on kaksi atomia? Olkoot ne samaa tai eri alkuainetta ja niiden haluttaisiin vuorovaikuttavan toisiinsa siten, että ne pysyisivät mahdollisimman lähellä toisiaan. Toisin sanoen niiden välille syntyisi kemiallinen sidos ja ne muodostaisivat molekyylin.
Eikö tällöin molempien atomien kannattaisi suunnata elektronipilveään siten, että niiden väliin syntyisi elektronitihentymä, joka toimisi liimana atomien välillä? Tällöinhän tämä negatiivisesti varautunut tihentymä vetäisi molempia positiivisesti varautuneita ytimiä puoleensa.
Molekyylisidoksen muodostuminen
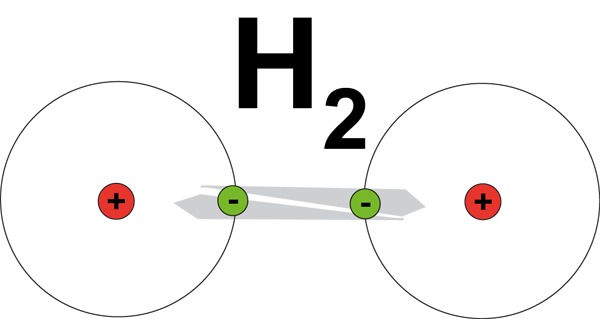
 Katsotaan kuorimallin avulla, kuinka yksinkertaisin molekyyli, vetymolekyyli, syntyy kahdesta vetyatomista. Kun molekyylisidoksen muodostumista mallinnetaan kuorimallin avulla, merkitään kullekin atomille sen ydin ja siihen alkuaineen järjestysluvun ilmoittama ytimen kokonaisvaraus +-merkkisenä. Elektronikuoret elektroneineen merkitään ytimen ympärille.
Katsotaan kuorimallin avulla, kuinka yksinkertaisin molekyyli, vetymolekyyli, syntyy kahdesta vetyatomista. Kun molekyylisidoksen muodostumista mallinnetaan kuorimallin avulla, merkitään kullekin atomille sen ydin ja siihen alkuaineen järjestysluvun ilmoittama ytimen kokonaisvaraus +-merkkisenä. Elektronikuoret elektroneineen merkitään ytimen ympärille.Molemmat vetyatomit luovuttavat ainoat elektroninsa yhteiseen käyttöön, jolloin syntyy yhteinen elektronipari. Tämän elektroniparin elektronit sijaitsevat suurimmaksi osaksi vety-ytimien välissä ja näin syntyy kemiallinen sidos, molekyyli- eli kovalenttinen sidos, joka pitää vetymolekyylin koossa.
Koska sidos muodostuu yhteisestä elektroniparista, molempien vetyatomien voidaan ajatella omaavan nämä kaksi elektronia uloimmalla kuorellaan ja siten saavuttavan oktettirakenteen.
Metaanimolekyyli
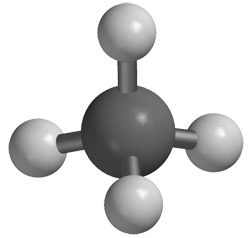 Metaanimolekyyli on vetymolekyyliä hieman monimutkaisempi, koska siinä on kahta eri alkuainetta, yksi hiiliatomi C ja neljä vetyatomia H. Metaani on siis yhdiste. Sen kemiallinen kaava on CH4. Koska kyseessä on molekyyli, kemiallista kaavaa kutsutaan myös molekyylikaavaksi.
Metaanimolekyyli on vetymolekyyliä hieman monimutkaisempi, koska siinä on kahta eri alkuainetta, yksi hiiliatomi C ja neljä vetyatomia H. Metaani on siis yhdiste. Sen kemiallinen kaava on CH4. Koska kyseessä on molekyyli, kemiallista kaavaa kutsutaan myös molekyylikaavaksi.
Periaate on sama kuin vetymolekyylin tapauksessa. Hiiliatomilla on uloimmalla kuorellaan neljä elektronia. Nämä neljä elektronia muodostavat elektroniparin kunkin vetyatomin elektronin kanssa. Muodostuu neljä molekyylisidosta ja näin neljä vetyatomia sitoutuu kemiallisesti hiiliatomiin.
Hiiliatomi muodostaa neljä yhteistä elektroniparia neljän vetyatomin kanssa, jolloin sen uloimmalla kuorella on 4 x 2 = 8 elektronia. Oktetti!
Kukin vetyatomi muodostaa yhden yhteisen elektroniparin hiiliatomin kanssa, joten sen uloimmalla kuorella on 2 elektronia. Oktetti!Etaanimolekyyli
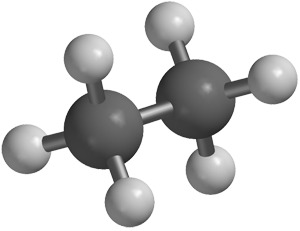 Etaanimolekyylissä on kaksi hiiliatomia ja kuusi vetyatomia, C2H6. Yksi molekyylisidos muodostuu hiiliatomien välille, joten kullekin hiiliatomille jää kolme elektronia muodostamaan elektroniparin kolmen vetyatomin elektronin kanssa. Kun useampi hiiliatomi on liittynyt yhteen, muodostuu hiiliketju. Siksi etaanin tapauksessa molekyylikaava C2H6 voidaan kirjoittaa myös muotoon CH3CH3 tai CH3-CH3.
Etaanimolekyylissä on kaksi hiiliatomia ja kuusi vetyatomia, C2H6. Yksi molekyylisidos muodostuu hiiliatomien välille, joten kullekin hiiliatomille jää kolme elektronia muodostamaan elektroniparin kolmen vetyatomin elektronin kanssa. Kun useampi hiiliatomi on liittynyt yhteen, muodostuu hiiliketju. Siksi etaanin tapauksessa molekyylikaava C2H6 voidaan kirjoittaa myös muotoon CH3CH3 tai CH3-CH3.Eteenimolekyyli
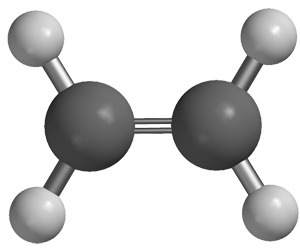 Kahden hiiliatomin välillä voi olla kaksi yhteistä elektroniparia. Toisin sanoen kaksi hiiliatomia on muodostanut keskenään kaksi molekyylisidosta, jota kutsutaan kaksoissidokseksi. Monet muutkin alkuaineet voivat muodostaa kaksoissidoksia joko saman tai jonkun muun alkuaineen kanssa. Tutussa happimolekyylissä O2, happiatomien välillä on kaksoissidos.
Kahden hiiliatomin välillä voi olla kaksi yhteistä elektroniparia. Toisin sanoen kaksi hiiliatomia on muodostanut keskenään kaksi molekyylisidosta, jota kutsutaan kaksoissidokseksi. Monet muutkin alkuaineet voivat muodostaa kaksoissidoksia joko saman tai jonkun muun alkuaineen kanssa. Tutussa happimolekyylissä O2, happiatomien välillä on kaksoissidos.
Kullekin hiiliatomille jää kaksi elektronia muodostamaan elektroniparin kahden vetyatomin elektronin kanssa. Molekyylikaava on C2H4 ja se voidaan kirjoittaa myös muotoon CH2CH2 tai CH2=CH2.
Koska eteenin hiiliatomien välissä on nyt elektroneja tiheämmässä, kaksoissidos on vahvempi kuin etaanin hiiliatomien välillä oleva yksinkertainen sidos. Kaksoissidos jäykistää molekyylin rakennetta.Etyynimolekyyli
 Kahden atomin välillä voi olla myös kolme elektroniparia, jolloin muodostuu kolmoissidos. Hiiliatomi pystyy muodostamaan toisen hiiliatomin kanssa kolmoissidoksen. Tässä tilanteessa molemmille hiiliatomille jää jäljelle vain yksi vapaa elektroni vetyatomeja varten. Kolmoissidos on vieläkin jäykempi kuin kaksoissidos.
Kahden atomin välillä voi olla myös kolme elektroniparia, jolloin muodostuu kolmoissidos. Hiiliatomi pystyy muodostamaan toisen hiiliatomin kanssa kolmoissidoksen. Tässä tilanteessa molemmille hiiliatomille jää jäljelle vain yksi vapaa elektroni vetyatomeja varten. Kolmoissidos on vieläkin jäykempi kuin kaksoissidos.