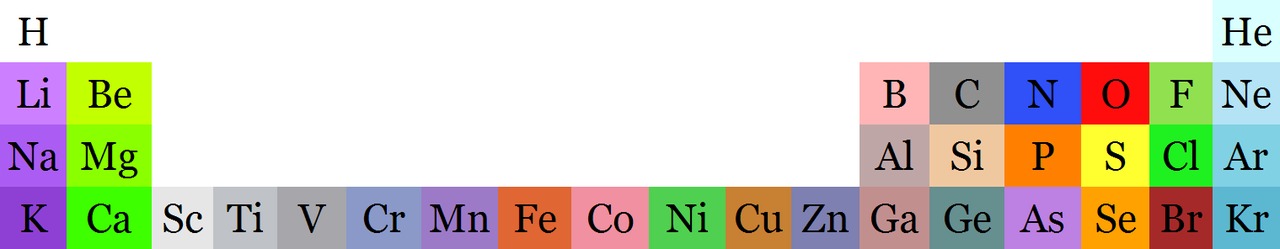3. Atomit ja kemialliset merkit
Johdanto
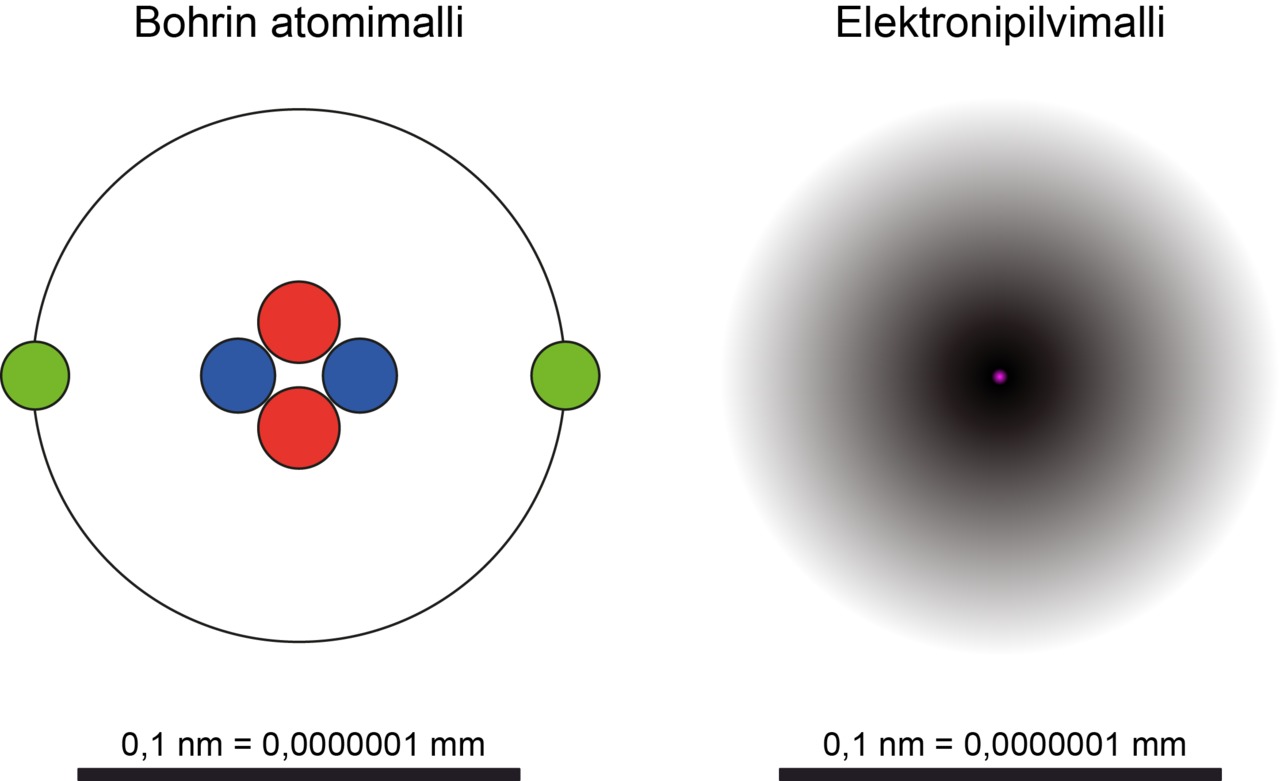
Protonit ja neutronit ovat ihmisen mittakaavassa hyvin pieniä, mutta elektroneihin verrattuna ne ovat jättiläisiä. Lisäksi protonit ja neutronit sijaitsevat atomin ytimessä, elektronit ytimen ympärillä. Elektronien yhteydessä puhutaan elektroniradoista, elektronikuorista tai elektronipilvistä. Ne ovat malleja joiden avulla atomien kemiallisia ominaisuuksia voidaan kuvata ymmärrettävästi.
Atomien sähkövaraus
 Kun hankaat ilmapallolla hiuksiasi, ilmapallo ja hiukset vetävät toisiaan puoleensa. Tämä johtuu siitä, että ilmapallo ja hiukset saavat hangatessa erimerkkiset sähkövaraukset. Tämä aiheuttaa niiden välille sähköisen vetovoiman. Kun viet ilmapallon pois, hiuksesi harottavat sinne tänne. Hiuksilla on keskenään samanmerkkiset sähkövaraukset ja ne hylkivät eli työntävät toisiaan poispäin toisistaan. Niiden välillä vallitsee sähköinen poistovoima.
Kun hankaat ilmapallolla hiuksiasi, ilmapallo ja hiukset vetävät toisiaan puoleensa. Tämä johtuu siitä, että ilmapallo ja hiukset saavat hangatessa erimerkkiset sähkövaraukset. Tämä aiheuttaa niiden välille sähköisen vetovoiman. Kun viet ilmapallon pois, hiuksesi harottavat sinne tänne. Hiuksilla on keskenään samanmerkkiset sähkövaraukset ja ne hylkivät eli työntävät toisiaan poispäin toisistaan. Niiden välillä vallitsee sähköinen poistovoima.Sähkövarauksia on kahdenlaisia, positiivisia (+) ja negatiivisia (–). Kun +- ja – -varauksia on yhtä paljon, ne kumoavat toisensa. Silloin sanotaan, että aine on sähköisesti neutraali. Sähkövarauksista tulet oppimaan lisää myös fysiikan opintojesi yhteydessä tutustuessasi sähköfysiikkaan.
Miten sähkövaraus liittyy atomiin?
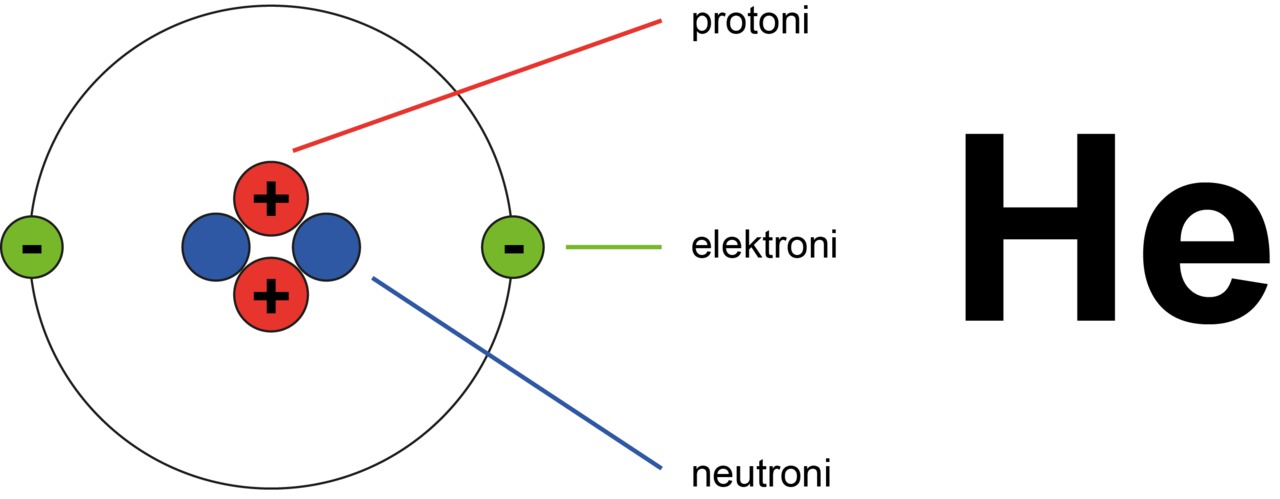
Atomin osista elektronilla on negatiivinen ja protonilla positiivinen sähkövaraus. Ne ovat etumerkkiä lukuun ottamatta saman suuruisia. Lisäksi nämä ovat pienimpiä mahdollisia varauksia, alkeisvarauksia. Siksi niille annetaan seuraavat suhteelliset arvot, +1 protonin ja -1 elektronin varaukselle. Neutronilla ei ole sähkövarausta eli se on nimensä mukaisesti neutraali. Atomissa on yhtä monta elektronia ja protonia, mistä seuraa että atomi on sähköisesti neutraali.
Ihmeteltävää atomeista
- Jos kerran elektronit ovat negatiivisesti ja protonit positiivisesti varautuneita, niin miksi ihmeessä elektronit eivät syöksy suoraan ytimeen protonien seuraksi?
- Tai jos samanmerkkisesti varautuneet protonit ovat pakkautuneet ytimeen, niin eikö niiden pitäisi työntää toisiaan kauemmas?
- Ja miten on ylipäätään mahdollista, että neutronit pysyvät ytimen sisällä?
Alkuaineet ja niiden kemialliset merkit
Mikä tekee tietynlaisista atomeista esimerkiksi happiatomeja?
Siihen on vain yksi syy: Kaikki ne atomit joiden ytimessä on kahdeksan protonia, ovat happiatomeja. Vastaavasti myös kaikki ne atomit joiden ytimessä on vain yksi protoni, ovat vetyatomeja.Siis protonien lukumäärä atomin ytimessä määrää, minkä alkuaineen atomi on kyseessä. Tätä protonien lukumäärää ytimessä kutsutaan kyseisen alkuaineen järjestysluvuksi. Näin alkuaineet saadaan järjestyslukunsa mukaiseen jonoon, jossa vety on paikalla 1, happi paikalla 8 ja esimerkiksi rauta paikalla 26.
Heliumatomissa on kaksi protonia. Heliumin järjestysluku on siis 2.
Alkuaineiden merkitsemiseen käytetään kansainvälisiä lyhenteitä eli kemiallisia merkkejä, jotka koostuvat yhdestä tai kahdesta kirjaimesta. Hapen kemiallinen merkki on O (kreikaksi oxys), vedyn H (kreikaksi hydrogenium) ja raudan Fe (latinaksi ferrum). Kemiallisella merkillä voidaan kuvata joko
- sellaista puhdasta ainetta, joka koostuu ainoastaan yhdestä alkuaineesta tai
- kyseisen alkuaineen yksittäistä atomia.
Kemiallisten merkkien lisäksi eri alkuaineiden atomeja voidaan kuvata myös pallomalleilla. Esimerkiksi happiatomia kuvataan punaisella, vetyatomia valkoisella ja hiiliatomia harmaalla tai mustalla pallolla. Kemistit ovat sopineet jokaiselle alkuaineelle oman värin sen vuoksi, että ne olisivat helpompia tunnistaa kuvattaessa jotakin kemiallista ilmiötä näiden pallomallien avulla.
Kunkin alkuaineen omaa väriä voidaan käyttää myös alkuaineiden jaksollisen järjestelmän taulukossa:
Alkuaineet luonnossa
 Vety on maailmankaikkeuden yleisin alkuaine, mutta maapallolla sitä esiintyy puhtaana vain pieniä määriä yläilmakehässä. Suurin osa maapallon vetyatomeista on sitoutunut moniin muihin alkuaineisiin. Kuvassa oikealla näkyy puhdasta vetykaasua avaruudessa.
Vety on maailmankaikkeuden yleisin alkuaine, mutta maapallolla sitä esiintyy puhtaana vain pieniä määriä yläilmakehässä. Suurin osa maapallon vetyatomeista on sitoutunut moniin muihin alkuaineisiin. Kuvassa oikealla näkyy puhdasta vetykaasua avaruudessa.Kulta puolestaan esiintyy maapallolla melkein yksinomaan puhtaana alkuaineena.

Yleisesti voidaan sanoa, että suurin osa 92 luonnonvaraisesta alkuaineesta on sitoutunut kemiallisesti yhden tai useamman muun alkuaineen kanssa.
Molekyylit muodostuvat atomeista
 Puhdas kulta koostuu pelkästään kulta-atomeista, jotka muodostavat hyvin säännöllisen rakenteen. Jos olisi mahdollista katsoa puhtaasta kullasta valmistetun kultasormuksen sisään, niin nähtäisiin joka suuntaan jatkuvia kulta-atomeista muodostuneita rivistöjä. Kullan rakenneosia ovat siis yksittäiset kulta-atomit.
Puhdas kulta koostuu pelkästään kulta-atomeista, jotka muodostavat hyvin säännöllisen rakenteen. Jos olisi mahdollista katsoa puhtaasta kullasta valmistetun kultasormuksen sisään, niin nähtäisiin joka suuntaan jatkuvia kulta-atomeista muodostuneita rivistöjä. Kullan rakenneosia ovat siis yksittäiset kulta-atomit.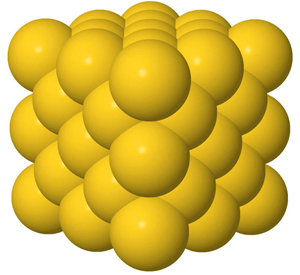
Puhtaan vedyn rakenne on erilainen. Sen rakenneosia ovat vetymolekyylit. Vetymolekyyli koostuu kahdesta vetyatomista, jotka ovat liittyneet toisiinsa kemiallisen sidoksen avulla.
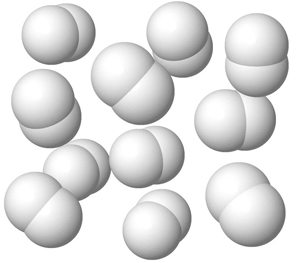
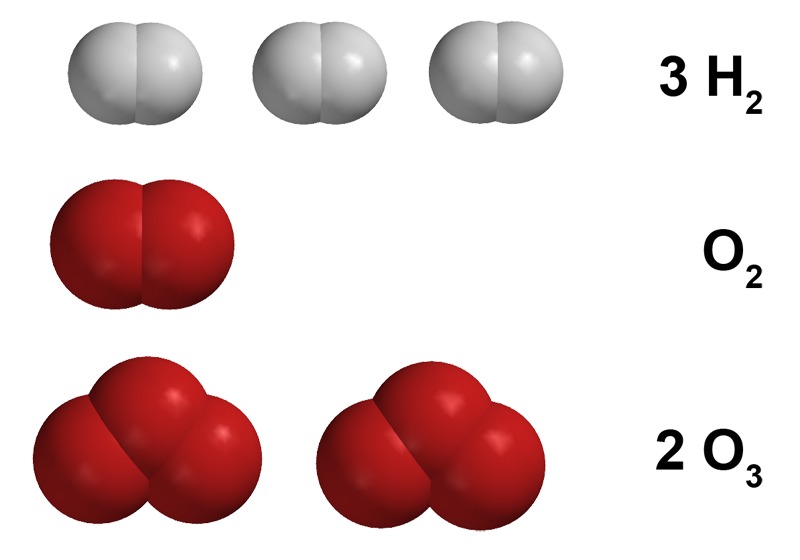
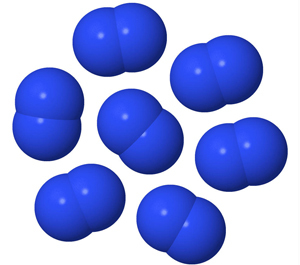 Myös puhtaan hapen ja typen rakenneosat ovat molekyylejä. Typpimolekyyli koostuu kahdesta typpiatomista, mutta hapen rakenneosana voi olla joko kahden happiatomin muodostama happimolekyyli tai kolmen happiatomin muodostama otsonimolekyyli.
Myös puhtaan hapen ja typen rakenneosat ovat molekyylejä. Typpimolekyyli koostuu kahdesta typpiatomista, mutta hapen rakenneosana voi olla joko kahden happiatomin muodostama happimolekyyli tai kolmen happiatomin muodostama otsonimolekyyli.
Molekyylien nimien lisäksi kemiassa käytetään usein pelkkiä kemiallisia merkkejä. Ensin kirjoitetaan kyseisen alkuaineen kemiallinen merkki ja sen jälkeen oikeaan alakulmaan molekyylissä esiintyvien atomien lukumäärä. Vetymolekyylin merkintä H2 kertoo, että se koostuu kahdesta vetyatomista. Jos näitä vetymolekyylejä on useampia, niin niiden lukumäärä merkitään molekyylin merkinnän eteen. Esimerkiksi kolme vetymolekyyliä merkitään 3 H2, yksi happimolekyyli merkitään O2 ja kaksi otsonimolekyyliä 2 O3.