6.4.2020 - Jaksollinen järjestelmä
Jaksollisen järjestelmän ominaisuuksia
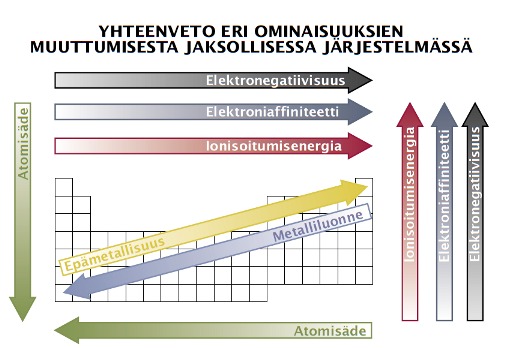
Elektronegatiivisuus on suhteellinen mitta, joka kuvaa sitä, miten voimakkaasti atomi vetää puoleensa yhteisiä sidoselektroneja molekyylissä. Esimerkiksi happiatomin elektronegatiivisuus on suurempi kuin vetyatomin, joten vesimolekyylissä suurempi osuus happi-vetysidosten elektronitiheydestä on happea lähellä.
Ionisoitumisenergia eli ionisaatioenergia (tunnus I tai Ei) on energia, joka vähintään tarvitaan elektronin irrottamiseksi kaasumaisesta atomista tai molekyylistä. Ilmoitetaan usein yksikössä kJ/mol Esim. Na(g) -> Na+(g) + e- ∆E = +494 kJ/mol. Ionisoitumisenergian avulla voidaan arvioida, kuinka helposti atomi luovuttaa elektronitiheyttään.
Elektroniaffiniteetti tarkoittaa energiamäärää (kJ/mol) joka sitoutuu tai vapautuu kun kaasufaasissa olevaan atomiin tai ioniin liittyy yksi elektroni. Esim. F(g) + e- F-(g) ∆E = - 328 kJ/mol.
Atomien kokoon vaikuttaa millä kuorella uloimmat elektronit ovat joten suuremmat atomit löytyvät alempaa jaksollisesta järjestelmästä. Toinen vaikuttava asia on positiivisen varauksen suuruus ytimessä joka vetää elektroneja puoleensa. Näin pienemmät atomit löytyvät oikeasta laidasta. Eli atomisäde kasvaa ryhmissä ja pienenee jaksoissa.
Metallit pyrkivät reagoimaan luovuttamalla elektroneja ja ne irtovat sitä helmpommin mitä kauempana ne ovat ytimestä. Epämetalleilla päinvastoin. Eli metallien reaktiokyky suurempi isommilla atomeilla, epämetallien pienillä.
Metallien ionit atomeja pienempiä, epämetalleilla suurempia koska metallien ioneilla vähemmän elektronikuoria ja epämetallien ioneilla ylimääräisiä elekroneja jotka hylkivät toisiaan.
Esimerkkeinä
Harjoituksia
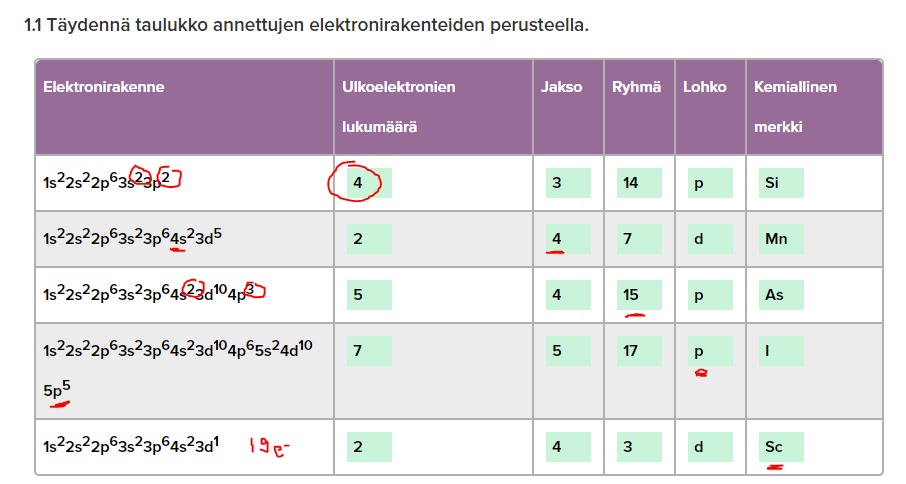
s.23 1.4
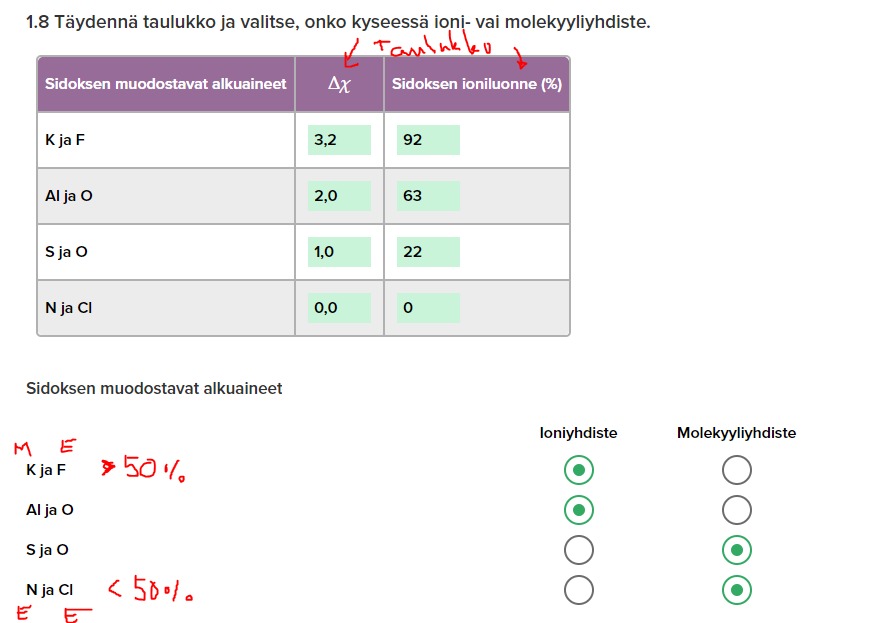
s.26 1.5 (palautettava)
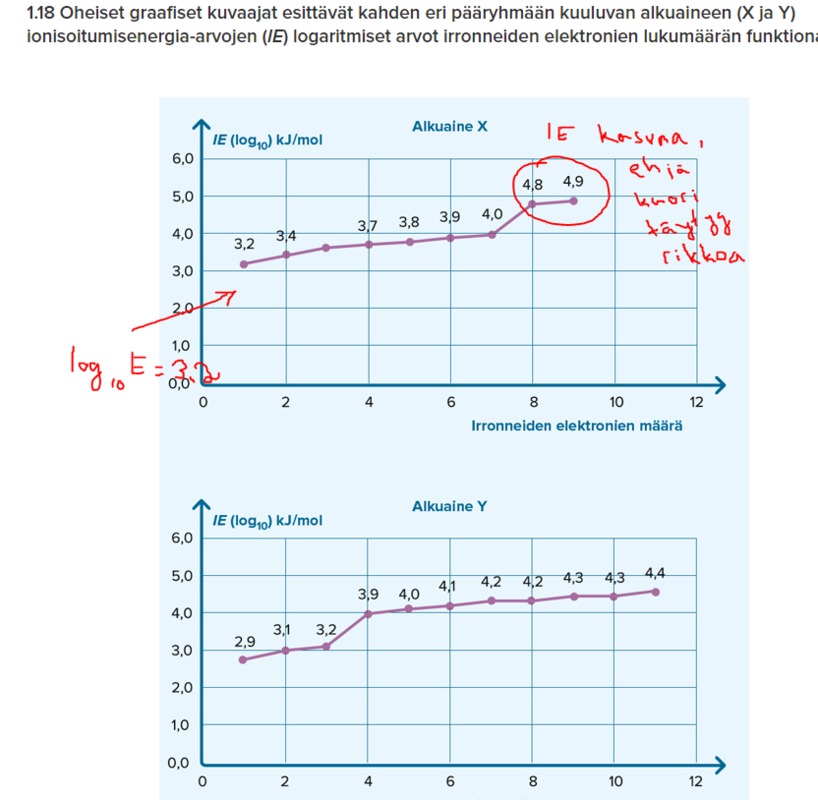
s.33 1.10, 1.12, 1.13, 1.15, 1.16