15.5.2020 - Normaalipotentiaali
Jalomman metallin hapettunut muoto (ionit) pelkistyy spontaanisti ollessaan yhteydessä epäjalomman metallin kanssa joka hapettuu.
https://vimeo.com/245173866/1a98121ef4
Jos elektronien siirto tapahtuu ulkoista johdinta pitkin saadaan sähköpari, jota voidaan hyödyntää sähköenergian tuotannossa.
Esim. Galvaaninen kenno
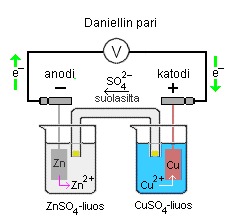
Daniellin pariksi sanotaan sinkin ja kuparin muodostamaa galvaanista kennoa, sama informaatio kuin yllä olevassa kuvassa voidaan esittää myös kennokaavion avulla (alla).
Zn(s) | ZnSO4(aq) || CuSO4(aq) | Cu(s)
Anodireaktio on hapettuminen ja se tapahtuu kennon negatiivisella navalla:
Anodi: Zn(s) → Zn2+(aq) + 2e-
Katodireaktio on pelkistyminen ja se tapahtuu kennon positiivisella navalla:
Katodi: Cu2+(aq) + 2e- → Cu(s)
Kennoreaktio on kokonaisreaktio joka saadaan laskemalla osareaktiot yhteen sen jälkeen kun ne on lavennuttu sellaisella luvulla että siirtyvien elektronien määrät ovat yhtä suuret.
Kenno: Zn(s) + Cu2+(aq)→ Zn2+(aq) + Cu(s)
https://vimeo.com/245175963/9965d5e527
Normaalipotentiaalin määrittäminen
Normaalivetyelektrodi: Vetykaasua kuplitetaan platinalevyn pintaan. Mitataan aineen ja vedyn välinen jännite galvaanisessa kennossa (c=1M, T= 298,15K, p=101,325 kPa).
Esim. Sinkin normaalipotentiaalin määrittäminen

Anodi: Zn(s) → Zn2+(aq) + 2e-
Katodi: 2 H+(aq) + 2e- → H2 (g)
Kenno: Zn(s) + 2 H+(aq) → Zn2+(aq) + H2 (g)
Jännite: 0,76V
Esim. Kuparin normaalipotentiaalia määritettäessä elektronit liikkuvat toiseen suuuntaan (vedyltä kuparille).
Anodi: H2 (g) → 2 H+(aq) + 2e-
Katodi: Cu2+(aq) + 2e- → Cu(s)
Kenno: H2 (g) + Cu2+(aq) → 2 H+(aq) + Cu(s)
Jännite: 0,34V
Sovitaan vedyn pelkistymispotentiaaliksi 0V ja herkemmin pelkistyvien potentiaali positiiviseksi.
Ep(Cu) = +0,34 V
Ep(Zn) = -0,76 V
Hapettumispotentiaali on tällöin pelkistymispotentiaalin vastaluku.
Näin voidaan ennustaa esim. Daniellin kennon
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
jännite
Sinkki hapettuu Eh = +0,76 V
Kupari pelkistyy Ep = +0,34 V
Ekenno = 1,10 V
Sähköparin elektrodien välinen jännite riippuu
- elektrodeilla reagoivien aineiden kyvystä sitoa elektroneja
- lämpötilasta
- kennossa olevien aineiden pitoisuuksista
- kennon kuormituksesta
(ei virtaa → suurin jännite eli lähdejännite)
(virta → hyötysuhde alle 100% eli napajännite aina lähdejännitettä pienempi)
2.15 Rautalevy upotetaan liuoksiin: Ag+(aq), Cu2+(aq) ja Mg2+(aq). Perustele normaalipotentiaalien avulla, missä liuoksissa rautalevyn pinnalle muodostuu metallikerros.
Ratkaisu:
Rautalevyn pinnalle muodostuu metallikerros liuoksissa, joissa on Ag+- tai Cu2+-ioneja.
Rauta on näitä metalleja epäjalompi (normaalipotentiaalitaulukossa ylempänä, löytyy taukkokirjasta), jolloin rauta-atomit hapettuvat ja hopea- tai kupari-ionit pelkistyvät alkuaine metalliksi.
Hopea-ioneja sisältävässä liuoksessa Eh + Ep = +0,45 V + 0,80 V = +1,25 V.
Kupari(II)-ioneja sisältävässä liuoksessa Eh + Ep = +0,45 V + 0,34 V = +0,79 V.
Opetus.tv :ssä hyvin videoita
https://opetus.tv/kemia/ke4/normaalipotentiaali/
Harjoituksia 2.13, 2.16, 2.17 (palauta A kohta, otetaan B esimerkkinä...)
