Energiatasot ja siirtymät monielektroniatomeissa
Vetyatomin ytimessä on yksi protoni ja ytimeen on sitoutunut yksi elektroni. Muiden atomien mallintaminen on monimutkaisempaa, koska niissä on useita keskenään vuorovaikuttavia elektroneja. Myös monielektroniatomien energiatilat ovat kvantittuneet, mikä ilmenee niiden viivamaisissa emissiospektreissä. Alla oleva kuva esittää neonin, heliumin ja vedyn spektriviivoja näkyvän valon alueella. Heliumilla ja neonilla on enemmän spektriviivoja, minkä selittää vetyä monimutkaisempi elektronitasorakenne.

Monielektroniatomeja mallinnetaan samoilla periaatteilla kuin vetyatomia, mutta niiden energiatiloille ei ole yksinkertaista laskukaavaa. Kaikki atomit absorboivat fotoneja, joiden energia [[$E_\text{fotoni}$]] on yhtä suuri kuin perustilan ja viritystilan välinen energiaero [[$\Delta E$]]. Atomit niin ikään emittoivat fotoneja, joiden energia on yhtä suuri kuin kahden tilan välinen energiaero. Energiaero ja fotonin aallonpituus kytkeytyvät siis toisiinsa seuraavalla kaavalla:
[[$ \quad \Delta E=\dfrac{hc}{\lambda_\text{fotoni}}$]]
Kuten aiemmin on kerrottu, elektronien käyttäytymistä atomissa kuvaa Schrödingerin yhtälö, josta voidaan ratkaista elektronien mahdolliset energiat. Monielektroniatomeille Schrödingerin yhtälö muodostuu monimutkaiseksi, eikä sitä pystytä ratkaisemaan tarkasti. Atomien perustilojen energiat ovat kuitenkin mitattavissa, ja muille tiloille voidaan ratkaista approksimaatiot. Tarkastelemalla aineen emissio- ja absorptiospektrejä voidaan laskea siirtymien energiat ja siten päätellä mahdolliset energiatilat. Niitä voidaan sitten vertailla erilaisiin Schrödingerin yhtälön approksimaatioihin. Mahdolliset energiatilat on kirjattu taulukoihin. Monipuolinen ja ilmainen lähde on esimerkiksi NIST (National Institute of Standards and Technology).
![]() Taulukoita alkuaineiden ominaisuuksista, mm. energiatilat (NIST eng.)
Taulukoita alkuaineiden ominaisuuksista, mm. energiatilat (NIST eng.)
Atomin monimutkaistuessa energiatilojen lukumäärä lisääntyy. Vaihtoehtoisia siirtymiä tilalta toiselle on enemmän ja spektriviivoja nähdään useampia kuin vedyllä. Alla on osa heliumin emissiospektriä.
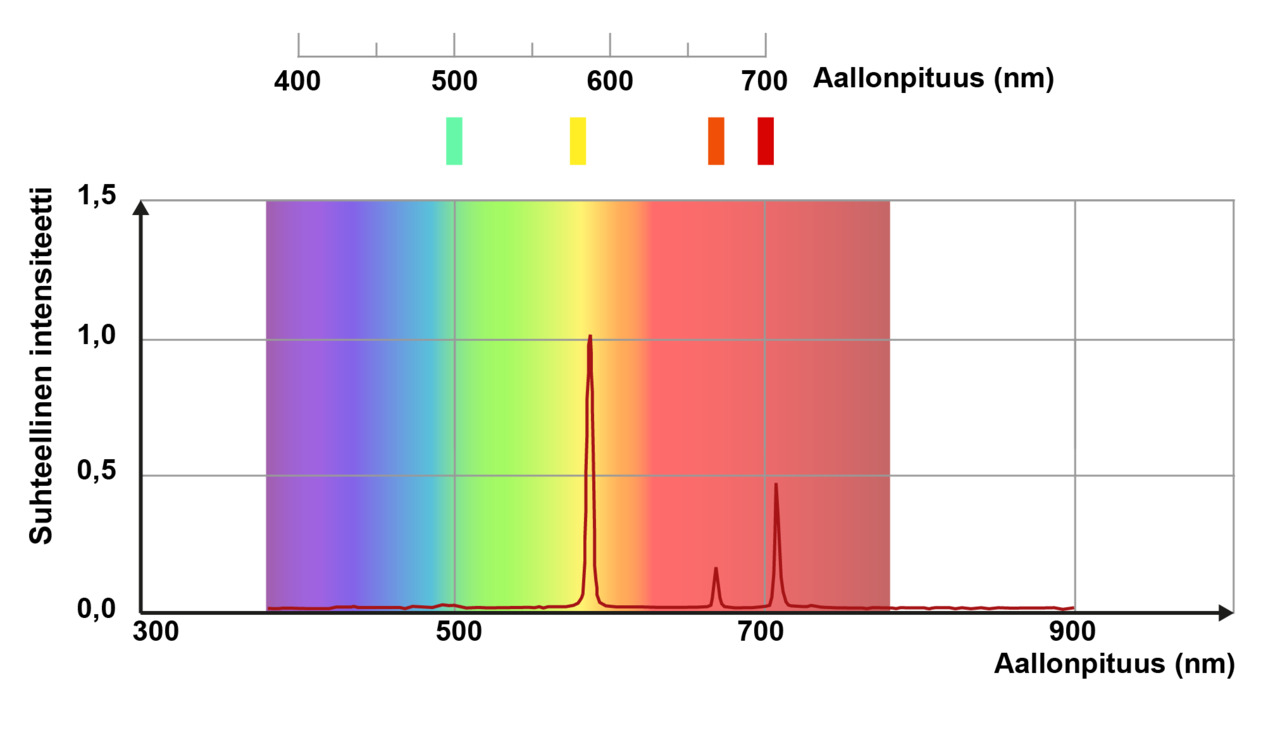
Heliumin emissiospektrin kirkkaimman kellertävän viivan aallonpituus on noin 590 nm. Tämän perusteella tiedetään, että spektriviivan synnyttäneiden energiatilojen välinen energiaero on ollut
[[$ \quad \Delta E=E_\text{fotoni} \\
\quad E_{\text{fotoni}}=\dfrac{hc}{\lambda} \\
\quad E_{\text{fotoni}}=\dfrac{4{,}136\cdot 10^{-15} \textrm{ eVs}\cdot 2{,}998\cdot 10^8 \textrm{ m/s}}{590 \cdot 10^{-9} \textrm{ m}}\approx 2{,}1 \textrm{ eV} $]]
Ohessa on heliumin energiatasokaavio, jossa on joitakin heliumin tunnettuja energiatiloja. Keltaista valoa vastannut energia 2,1 eV on siirtymä kolmannelta viritystilalta ensimmäiselle viritystilalle. Siirtymä on merkitty kuvaan. Heliumin perustilan ja viritystilojen välillä on suuri, yli 20 eV:n, energiaero. Näin ollen heliumin siirtyessä perustilaan emittoituu UV-säteilyä. Näkyvää valoa syntyy vain viritystilojen välisissä siirtymissä.
