2.1 Atomi ja sen spektrin synty
Atomin rakenne
Atomin ydin koostuu protoneista ja neutroneista. Protoni on sähkövaraukseltaan positiivinen, yhden alkeisvarauksen suuruinen. Neutronit ovat sähkövaraukseltaan neutraaleja. Näin ollen atomiytimen sähkövaraus on positiivinen, ja protonien lukumäärä määrää alkuaineen. Esimerkiksi hiiliatomeissa on kuusi protonia.
Atomiytimen ympärillä on negatiivisesti varattuja elektroneja. Yhden elektronin varaus on alkeisvarauksen suuruinen. Atomissa on aina yhtä monta elektronia kuin protonia. Siten atomit ovat sähköisesti neutraaleja hiukkasia.

Ennen kvanttimekaniikkaa ei pystytty selittämään, miten atomi voi olla olemassa. Negatiivisten elektronien kuviteltiin kiertävän positiivista atomiydintä Coulombin voiman vetäessä niitä keskelle, samaan tapaan kuin planeetat kiertävät Aurinkoa gravitaatiovoiman vetäminä. Ympyräradalla olevat kappaleet ovat kuitenkin kiihtyvässä liikkeessä. Sähkömagnetismin teoriasta tiedetään, että kiihtyvässä liikkeessä olevat sähkövaraukset lähettävät sähkömagneettista säteilyä. Näin ollen elektronin pitäisi menettää energiaansa ja pudota atomiytimeen.
Kvanttimekaniikan avulla ymmärrettiin, että elektronit eivät käyttäydy pistemäisinä hiukkasina. Ne eivät kierrä ydintä, vaan ovat sen ympärillä muodostaen elektronipilven. Elektronin tarkkaa paikkaa ei voi määrittää, mutta sen sijainnin todennäköisyysjakauma voidaan ratkaista Schrödingerin yhtälöstä. Jokainen saatu todennäköisyysjakauma vastaa tiettyä energiaa. Edellisen luvun hiukkanen laatikossa -esimerkin tavoin elektronin energiatilat ovat kvantittuneet, ja niille saadaan täsmälliset lukuarvot.
Viivaspektrin synty atomeissa
Kirjassa Resonanssi 7 todettiin, että aine lähettää lämpötilastaan riippuvaa säteilyä, jonka ideaalimallia kutsutaan mustan kappaleen säteilyksi. Tällainen säteily syntyy aineen rakenneosasten satunnaisesta lämpöliikkeestä. Mustan kappaleen säteily sisältää kaikkia aallonpituuksia, ja sen spektri on jatkuva. Mustan kappaleen säteily on sitä lyhytaaltoisempaa, mitä korkeampi on säteilevän kappaleen lämpötila.
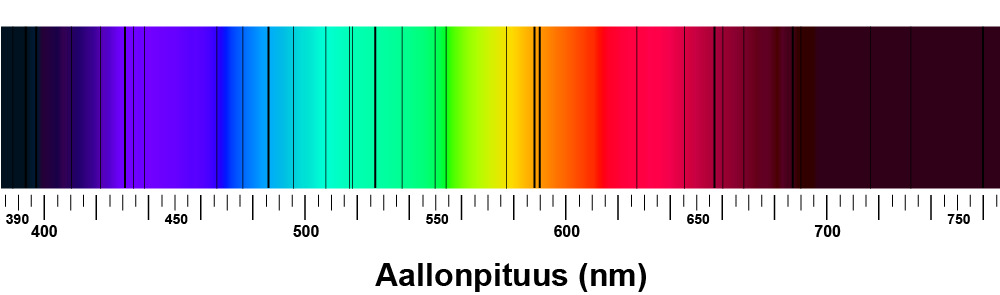
Joidenkin säteilijöiden on havaittu tuottavan viivaspektrejä, joissa on yhtä tai vain tiettyjä aallonpituuksia. Esimerkiksi eri alkuaineet tuottavat erivärisiä liekkejä, kun niitä kuumennetaan ja aine höyrystyy. Menetelmä tunnetaan kemiassa liekkikokeina. Liekkien eri värit johtuvat siitä, että niissä emittoituu valoa vain tietyillä aallonpituuksilla. Spektroskopian kehittyessä 1800-luvulla havaittiin, että jokaisen alkuaineen emissioviivat ovat aina alkuaineelle ominaisissa kohdissa. Näin aine voidaan tunnistaa sen emittoiman säteilyn perusteella. Alla on esitetty neljän eri alkuaineen emittoima viivaspektri.

Viivaspektrin synty osattiin selittää vasta kvanttimekaniikan avulla 1900-luvulla. Atomin elektroniverhossa elektronien energiat ovat kvantittuneet, ja elektronilla on vain tiettyjä energiatiloja. Kun elektroni siirtyy yhdeltä energiatilalta alemmalle, vapautuu energiaa. Energia vapautuu atomista emittoituvana fotonina. Koska vain tietyt energiatilat ovat mahdollisia, emittoituvilla fotoneilla ei voi olla mitä tahansa energioita. Alkuaineiden atomeista emittoituu fotoneja vain tietyillä energioilla, jotka vastaavat elektronien energiatilojen eroja. Elektronien energiatilat ovat alkuaineille ominaisia, joten niiden spektrit poikkeavat toisistaan.
Alkuaineiden atomit myös absorboivat fotoneja vain tietyillä energioilla. Fotonin energian tulee olla juuri sopiva, jotta se vastaa elektronin kahden energiatilan välistä eroa. Fotonilla ei saa olla energiaa enempää eikä vähempää kuin tilojen välinen energiaero, jotta absorptio tapahtuu. Kuten valosähköisessä ilmiössä, yksittäisen fotonin täytyy absorboitua kokonaisuudessaan sen vuorovaikuttaessa elektronin kanssa. Alla on kuva Auringon spektrissä olevista Fraunhoferin viivoista. Vaikka Aurinko emittoi mustan kappaleen säteilyä, eli kaikkia aallonpituuksia, havaitusta spektristä puuttuu muutamia yksittäisiä aallonpituuksia. Nämä vastaavat niitä aallonpituuksia, joilla Auringon kaasukehässä olevat alkuaineet voivat absorboida säteilyä.
Emissio, absorptio ja atomin energiatasot
 Elektronien energiatasoja kuvataan kaaviolla. Kaaviossa elektronin energiatilojen arvot ovat negatiivisia ja kaavio päättyy nollaan. Mitä negatiivisempi elektronin energia on, sitä voimakkaammin se on sitoutunut atomiytimeen. Kun elektronin energia on nolla, elektronilla on riittävästi energiaa irrotakseen atomiytimen vaikutuspiiristä, eli tapahtuu ionisaatio. Elektronit siirtyvät luonnostaan alimmalle mahdolliselle energiatilalle. Alinta energiatilaa kutsutaan perustilaksi, ja sen energiaa merkitään tunnuksella [[$E_1$]]. Perustilaa korkeammat energiatilat ([[$E_2$]], [[$E_3$]], ...) ovat viritystiloja. Oheisessa kuvassa on vedyn energiatasokaavio, jossa elektroni on merkitty perustilaan.
Elektronien energiatasoja kuvataan kaaviolla. Kaaviossa elektronin energiatilojen arvot ovat negatiivisia ja kaavio päättyy nollaan. Mitä negatiivisempi elektronin energia on, sitä voimakkaammin se on sitoutunut atomiytimeen. Kun elektronin energia on nolla, elektronilla on riittävästi energiaa irrotakseen atomiytimen vaikutuspiiristä, eli tapahtuu ionisaatio. Elektronit siirtyvät luonnostaan alimmalle mahdolliselle energiatilalle. Alinta energiatilaa kutsutaan perustilaksi, ja sen energiaa merkitään tunnuksella [[$E_1$]]. Perustilaa korkeammat energiatilat ([[$E_2$]], [[$E_3$]], ...) ovat viritystiloja. Oheisessa kuvassa on vedyn energiatasokaavio, jossa elektroni on merkitty perustilaan.
Absorptiossa aineeseen osuu säteilyä, jossa fotonin energia muuntuu elektronin energiaksi ja siirtää sen ylemmälle energiatilalle. Tämä tarkoittaa atomin virittymistä korkeampaan energiatilaan. Aineen läpi kulkeneen säteilyn spektrissä erottuu absorptioviivoja, puuttuvia aallonpituuksia. Absorboituneiden fotonien energiat vastaavat kahden energiatilan välistä energiaeroa, joka virittää atomin. Absorboitumista perustilasta johonkin ylempään energiatilaan [[$n$]] kuvaa yhtälö
[[$\qquad E_1+E_\text{fotoni}=E_n$]],
jossa [[$n$]] on kokonaisluku ja jokin viritystiloista. Atomin energian muutos on siis [[$\Delta E=E_n-E_1$]], joka on absorboituvan fotonin energian suuruinen.
Alla oleva simulaatio mallintaa vetyatomin energiatiloja ja atomiin osuvaa säteilyä. Perustilan energia on noin -13,6 eV. Aallonpituutta säätämällä voit huomata, miten tietyt aallonpituudet saavat aikaan virittymisen ja muut aallonpituudet eivät. Tarpeeksi pienillä aallonpituuksilla fotonin energia ylittää 13,6 eV, mikä saa elektronin irtoamaan atomista, eli atomi ionisoituu.
Viritystilat purkautuvat nopeasti takaisin perustilaan. Tällöin vapautuu energiaa, mikä havaitaan emittoituvina fotoneina. Vapautuvan energian suuruus [[$\Delta E$]] ja fotonin aallonpituus riippuvat siitä, millainen muutos elektroniverhossa tapahtuu. Elektroni voi siirtyä viritystilalta johonkin alempaan viritystilaan tai suoraan perustilaan. Emissiospektri sisältää yksittäisiä, toisistaan erillisiä aallonpituuksia eli spektriviivoja. Energian muutosta kuvaa yhtälö
[[$\qquad E_n=E_\text{fotoni}+E_m$]],
missä [[$n$]] on viritystila alussa, ja [[$m$]] on viritystila lopussa (tai perustila, jos [[$m=1$]]). Alla oleva simulaatio mallintaa vetyatomin viritystilojen mahdollisia purkautumisia ja näissä emittoituvia aallonpituuksia.
Atomi voi emittoida kaikkia aallonpituuksia, joilla sen virittyminen tapahtuu. Emissiospektrissä havaitaan lisäksi muita aallonpituuksia. Koska viritystilat purkaantuvat nopeasti, on erittäin epätodennäköistä, että valmiiksi viritystilassa oleva elektroni absorboi sopivan fotonin virittyäkseen korkeammalle energiatilalle. Täten nämä viivat eivät käytännössä erotu absorptiospektrissä. Emissiospektrissä on siten enemmän spektriviivoja kuin absorptiospektrissä.
Emittoituvan tai absorboituvan fotonin aallonpituus
Atomit absorboivat ja emittoivat vain itselleen ominaisia tiettyjä aallonpituuksia. Absorptiospektrissä nähdään puuttuvia aallonpituuksia aineelle ominaisissa kohdissa. Emissiospektri taas sisältää vain yksittäisiä, toisistaan erillisiä aallonpituuksia. Tietyn alkuaineen absorptio- ja emissiospektrien viivat ovat samat, mutta kaikkia aallonpituuksia ei havaita absorptiospektrissä.
Atomin elektroni voi siirtyä korkeampaan energiatilaan eli viritystilaan absorboimalla fotonin. Kun elektroni palaa alempaan energiatilaan, atomi emittoi fotonin. Absorboituvan tai emittoituvan fotonin energian täytyy olla yhtä suuri kuin elektronin kahden energiatilan erotus: [[$E_\text{fotoni}=\Delta E$]].
Fotonin aallonpituus ratkaistaan energiaerotuksesta fotonin energian ja aallonpituuden välisen yhteyden avulla.
[[$\qquad\begin {align*} E_\text{fotoni}&=\dfrac{hc}{\lambda} \\ \lambda &=\dfrac{hc}{\Delta E} \end {align*}$]]

Elektronin energiatilat vetyatomissa
Vetyatomin energiatilat voidaan laskea. Ne saadaan Schrödingerin yhtälön ratkaisuina samaan tapaan kuin edellisessä alaluvussa laatikossa olevan elektronin energiat. Lukiotason ylittävän laskun lopputuloksena saadaan elektronin energiatilat vetyatomissa.
Elektronin energiatilat vetyatomissa
[[$ \qquad E_n=-\dfrac{1}{n^2}\dfrac{m_\text{e}e^4}{8\epsilon_0^2h^2}\approx-\dfrac{1}{n^2}\cdot 13{,}6\text{ eV}$]]
Tässä [[$m_\text{e}$]] on elektronin massa, ja [[$e$]] on sen varaus, [[$\epsilon_0$]] on tyhjiön permittiivisyys, ja [[$h$]] on Planckin vakio. [[$n$]] on energiatilaa kuvaava jokin positiivinen kokonaisluku.
Laskujen kannalta on yleensä riittävää käyttää likiarvoa 13,6 eV luonnonvakioiden yhdistelmälle.
Vetyatomin perustilalla [[$n=1$]] elektronin energia on -13,6 eV. Seuraavan tilan [[$n=2$]] energia on [[$E_2=-\dfrac{1}{2^2}\cdot 13{,}6\text{ eV}=-3{,}4\text{ eV}$]]. Tämä on elektronin ensimmäinen viritystila vetyatomissa. Pienin mahdollinen energia, jolla vetyatomi voi virittyä, on perustilan ja ensimmäisen viritystilan energioiden erotus eli 10,2 eV. Tämän suuruinen energia on UV-valon fotoneilla. Näkyvän valon fotonien energiat ovat vähäisempiä, joten ne eivät absorboidu vetykaasuun.
Elektroni irtoaa vetyatomista eli atomi ionisoituu, kun sen energia nousee perustilalta nollatasolle. Vedyn ionisaatioon vaadittu energia on siten 13,6 eV. Kaikki tätä suuremman energian omaavat fotonit absorboituvat vetykaasuun. Ionisaatioenergian ylittävä fotonin energia jää irronneen elektronin liike-energiaksi.
Vedyn emissioviivat määräytyvät siten, että vapautuvan fotonin energia on kahden energian [[$E_n$]] ja [[$E_m$]] erotus. Näkyvän alueen fotonien energia on muutaman elektronivoltin luokkaa. Näkyvää valoa emittoituu näin ollen siirtymissä, joissa vedyn elektroni päätyy ensimmäiseen viritystilaan. Alla oleva kuva havainnollistaa säteilyn absorptiota ja emissiota vetyatomissa.
Pysähdy pohtimaan
Esimerkkejä
Esimerkki 1
Laske vapautuvan fotonin energia ja aallonpituus, kun vedyn 4. viritystila purkautuu perustilaan.
Esimerkki 2
Määritä lyhyin ja pisin mahdollinen aallonpituus, joita voi emittoitua vedyn 3. viritystilan purkautuessa.
Esimerkki 3
Millainen aallonpituus sähkömagneettisella säteilyllä pitää olla, jotta se voisi ionisoida vetyatomin?