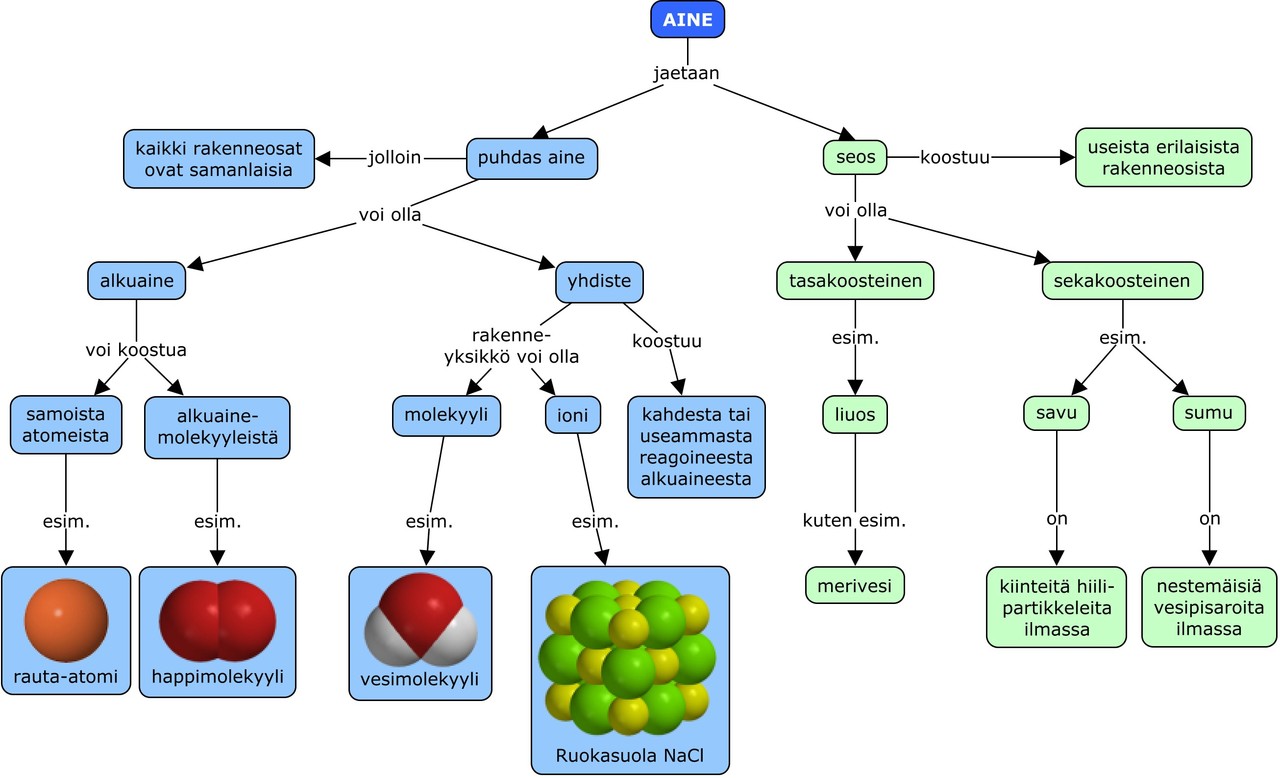
1. Ioniyhdisteet ja ionisidos
1. Virittäytyminen – onko ioni atomi?
2. Ioniyhdisteet ovat kovia ja kiteisiä
Sokeri ja suola vaikuttavat ulkoisesti tarkasteltuna hyvin samanlaisilta. Molemmat ovat kiteisiä aineita, jotka suurina kasoina näyttävät valkoiselta jauheelta. Atomien tasolla tarkasteltuna niiden rakenteet poikkeavat merkittävästi toisistaan.
Olennaisin eroavuus on atomien sitoutumistavassa. Sokerin perusyksikkö on molekyyli (C6H12O6), ja suolan perusyksikkönä ovat erimerkkisesti varautuneet ionit (Na+ ja Cl−). Sokeri rakentuu molekyyliverkostosta ja suola ioniverkostosta. Tämä vaikuttaa liukoisuuteen. Molemmat aineet liukenevat hyvin veteen, mutta sokeri hajoaa molekyyleiksi ja suola ioneiksi.

Tutki suolan liukenemista videon avulla ja vertaa alta löytyvään sokerin liukenemiskuvaan. Suola on ioniyhdiste ja se liukenee veteen ioneina.

Myös sokeri liukenee hyvin veteen. Sokeri on molekyyliyhdiste ja liukenee veteen molekyyleinä.
3. Ioni on sähköisesti varautunut hiukkanen
Atomista tulee varautunut hiukkanen, ioni, jos siihen tulee jostain lisää negatiivisesti varautuneita elektroneja tai niitä lähtee pois. Jos elektroneja tulee atomiin lisää, elektronien yhteenlaskettu lukumäärä on suurempi kuin ytimessä olevien protonien lukumäärä, joten ioni on kokonaisuudessaan negatiivisesti varautunut. Negatiivisesti varautunutta ionia nimitetään anioniksi.
Jos elektroneja lähtee pois atomista, on elektronien yhteenlaskettu määrä pienempi kuin ytimessä olevien protonien lukumäärä. Näin ioni on positiivisesti varautunut. Positiivisesti varautunutta ionia nimitetään kationiksi. Ionissa olevan sähköisen varauksen suuruus ilmoitetaan numerolla. Esimerkiksi positiivisesti varautuneen vetyionin varaus on +1, ja negatiivisesti varautuneen kloridi-ionin varaus −1.

4. Ionisidoksen muodostuminen
 Kovalenttisessa sidoksessa sitoutuvat atomit muodostavat keskenään yhden tai useamman yhteisen elektroniparin. Näin tapahtuu, jos sitoutuvien atomien ytimet kohdistavat elektroneihin suurin piirtein yhtä voimakkaan vuorovaikutuksen.
Kovalenttisessa sidoksessa sitoutuvat atomit muodostavat keskenään yhden tai useamman yhteisen elektroniparin. Näin tapahtuu, jos sitoutuvien atomien ytimet kohdistavat elektroneihin suurin piirtein yhtä voimakkaan vuorovaikutuksen.
Aina näin ei ole. Joissain tapauksissa sitoutuvat atomit kohdistavat elektroneihin selvästi erilaisen vuorovaikutuksen ja yksi tai useampi elektroni siirtyy kokonaan atomilta toiselle ja muodostuu sähköisesti erimerkkisesti varautuneita ioneja. Varausero synnyttää sähköisen vetovoiman, jota nimitetään ionisidokseksi.
Vertaile sidostyyppien muodostumista oheisen kaavion avulla.

5. Ioniyhdisteiden ominaisuuksia

Ioniyhdiste rakentuu positiivisista ja negatiivisista ioneista, jotka muodostavat kiinteässä olomuodossa ollessaan säännöllisen, kolmiulotteisen kiderakenteen.
Tuttuja ioniyhdisteitä ovat esimerkiksi ruokasuola NaCl ja monet kivilajit, kuten kuvan graniitti.

Ruokasuolaa ja graniittia.
Korkeat sulamis- ja kiehumispisteet
Ionien väliset sähköiset vetovoimat ovat vahvoja. Ioneista rakentuvat aineet ovat kovia, ja niillä on korkeat sulamis- ja kiehumispisteet. Ioniyhdiste kuitenkin rikkoontuu iskusta, kun samanmerkkiset ionit joutuvat vastakkain.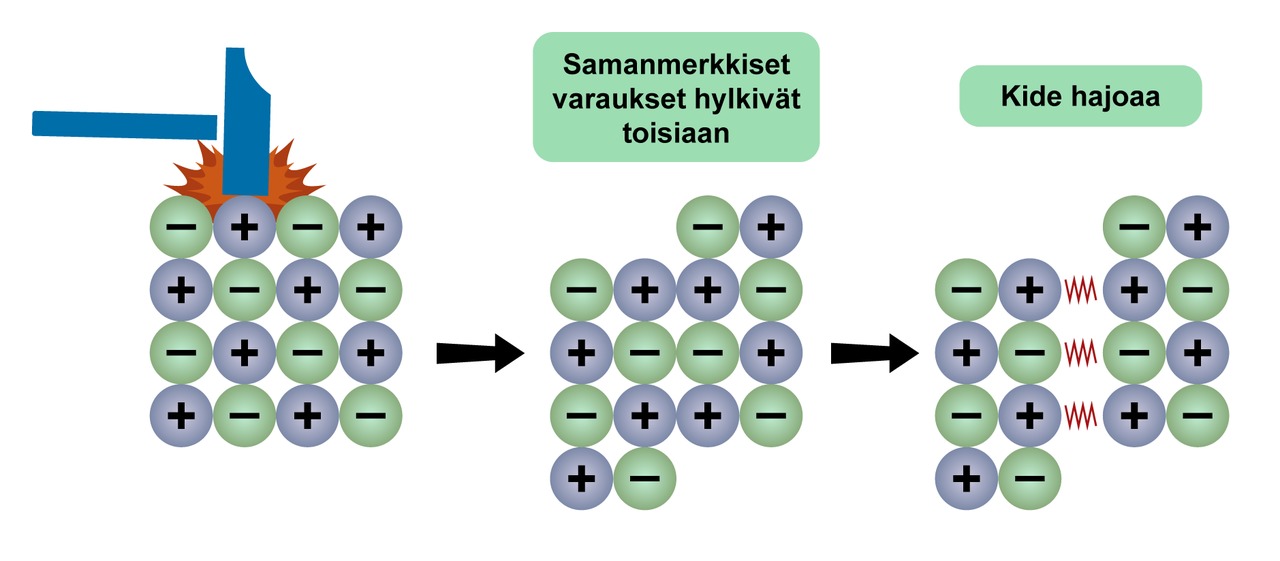
Liukoisuus
Ioniyhdisteet liukenevat veteen, mutta liukoisuuksista on suuria eroja. Esimerkiksi ruokasuola liukenee helposti veteen, kun taas monet kivilajit huonosti. Sulana ja vesiliuoksina ioniyhdisteet johtavat hyvin sähköä, kun taas kiinteänä ja kuivana ne ovat hyviä sähkön-, ja lämmöneristeitä. Ioniyhdisteiden sähkönjohtavuus perustuu siihen, että vesimolekyylit liikkuvat ionien väliin, mikä heikentää ionien välistä sähköistä vetovoimaa. Ionit joutuvat yhtä etäämmälle toisistaan, kunnes lopulta eroavat kokonaan. Ionit siirtyvät veden joukkoon ja voivat toimia sähkön kuljettajina. Ioniyhdisteen kuumentaminen saa ionit värähtelemään yhä voimakkaammin. Jossain vaiheessa värähtely on niin voimakasta, että ionit irtoavat toisistaan ja aine sulaa. Sulassa ionit pääsevät liikkumaan vapaasti ja toimimaan sähkönkuljettajina.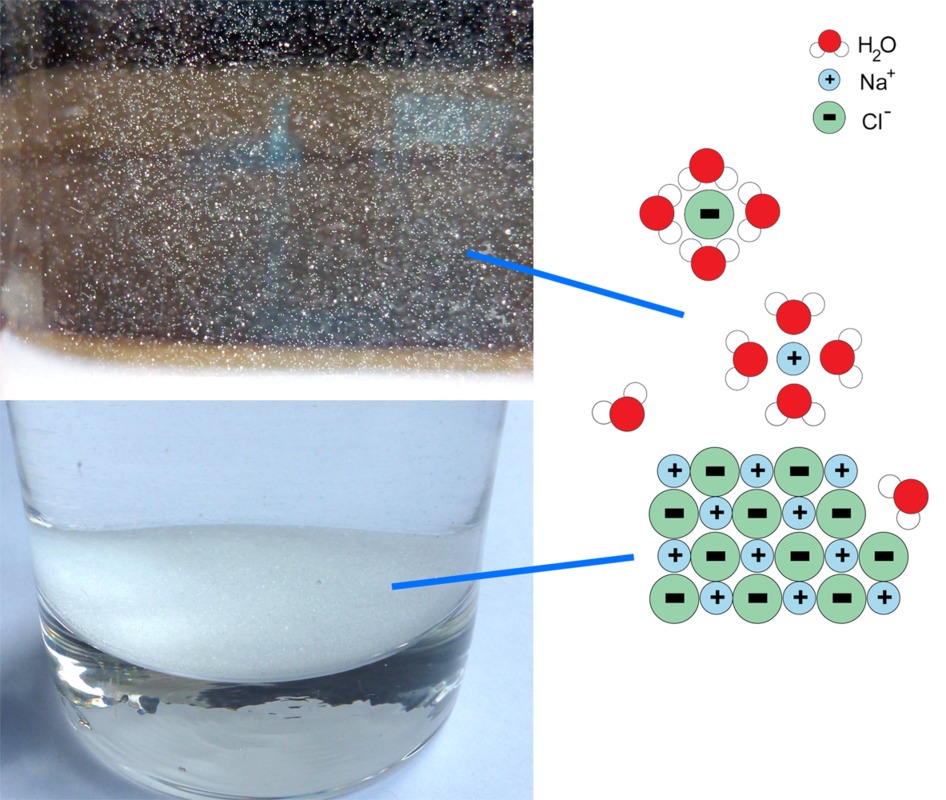
Video erilaisten yhdisteiden sähkönjohtavuudesta. Tarkkaile johtokykymittarin punaista valoa.
6. Ioniyhdisteitä muodostuu monissa reaktioissa
Arkipuheessa suolalla tarkoitetaan yleensä ruokasuolaa (NaCl), mutta kemiassa suola tarkoittaa suurta joukkoa ioniyhdisteitä. Ruokasuolan lisäksi suoloja ovat esimerkiksi kalsiumfluoridi ja rautaoksidi eli ruoste. Suoloja muodostuu muun muassa
- neutraloitumisreaktioissa
- metallin ja epämetallin reaktiossa
- saostumisreaktioissa
- hapon ja metallin reaktiossa.
Neutraloitumisreaktio
Happojen ja emästen neutraloitumisreaktiossa muodostuu suolaa ja vettä. Reaktion päätyttyä suola on veteen liuenneena, mutta kun vesi haihdutetaan pois, suola saadaan talteen kiinteänä ioniyhdisteenä. Neutraloitumisreaktiossa syntyvä suola syntyy hapon negatiivisesta ja emäksen positiivisesta ionista.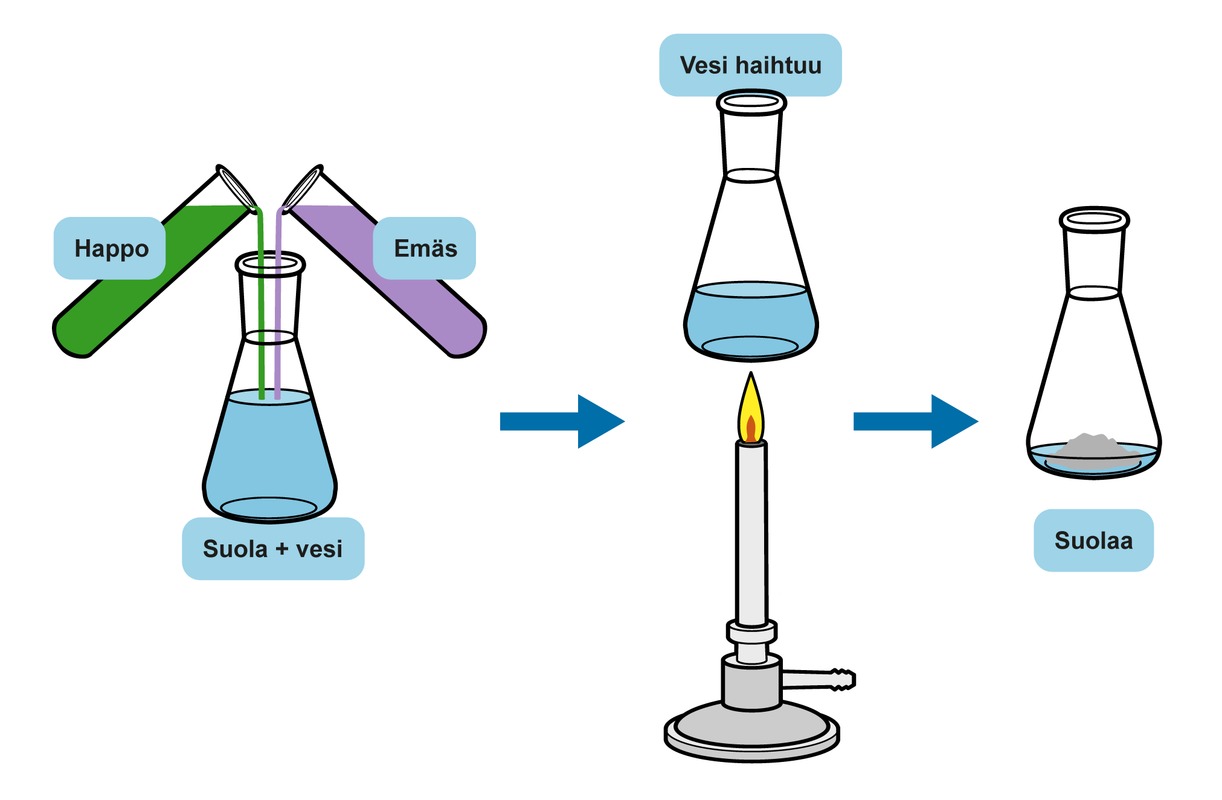
Hapon ja emäksen reaktiossa muodostu suolaa ja vettä. Kun vesi haihdutetaan, astiaan jää suolaa.
Metallin ja epämetallin reaktio
Metallin ja epämetallin reaktiossa voi muodostua suolaa. Esimerkiksi raudan palaessa muodostuu rautaoksidia. Raudan palamista tapahtuu esimerkiksi ruostumisessa, tähtisädetikun palaessa ja poltettaessa rautavillaa kemian tunnilla.
Alumiini ja jodi reagoivat kiivaasti muodostaen alumiinijodidia.
Saostumisreaktio
Saostumisreaktiossa muodostuu suolaa. Saostumisreaktiossa sekoitetaan toisiinsa kahta tai useampaa suolaliuosta. Lähtötilanteessa liuoksissa olevat ionit ovat veteen liuenneina, mutta kun liuokset sekoitetaan, eri liuosten ionit voivat reagoida keskenään, jolloin voi muodostua uusia veteen liukenemattomia suoloja.
Kobolttisulfaatin positiiviset koboltti-ionit ja ammoniumhydroksidin negatiiviset hydroksidi-ionit muodostavat veteen niukkaliukoisen kobolttihydroksidin.
Metallin ja hapon reaktio
Metallin ja hapon reaktiossa voi muodostua suolaa. Esimerkiksi kun sinkkiä liuotetaan suolahappoon ja vesi haihdutetaan pois, jäljelle jää tahmea suola.Tiivistelmä
- Ioni on varautunut atomi.
- Kationi on positiivisesti varautunut ioni ja anioni negatiivisesti varautunut.
- Suolan perusyksikkönä ovat erimerkkisesti varautuneet ionit.
- Ioniyhdiste rakentuu positiivisista ja negatiivisista ioneista.
- Ioniyhdisteillä on korkeat sulamis- ja kiehumispisteet. Ne ovat kovia ja liukenevat veteen.