3. Ryhmät ja jaksot
1. Ryhmät ja jaksot
Jaksollisen järjestelmän pystyrivejä sanotaan ryhmiksi ja vaakarivejä jaksoiksi. Monet alkuaineiden ominaisuuksista muuttuvat säännöllisesti siirryttäessä jaksollisessa järjestelmässä jaksossa vasemmalta oikealle tai ryhmässä ylhäältä alas.
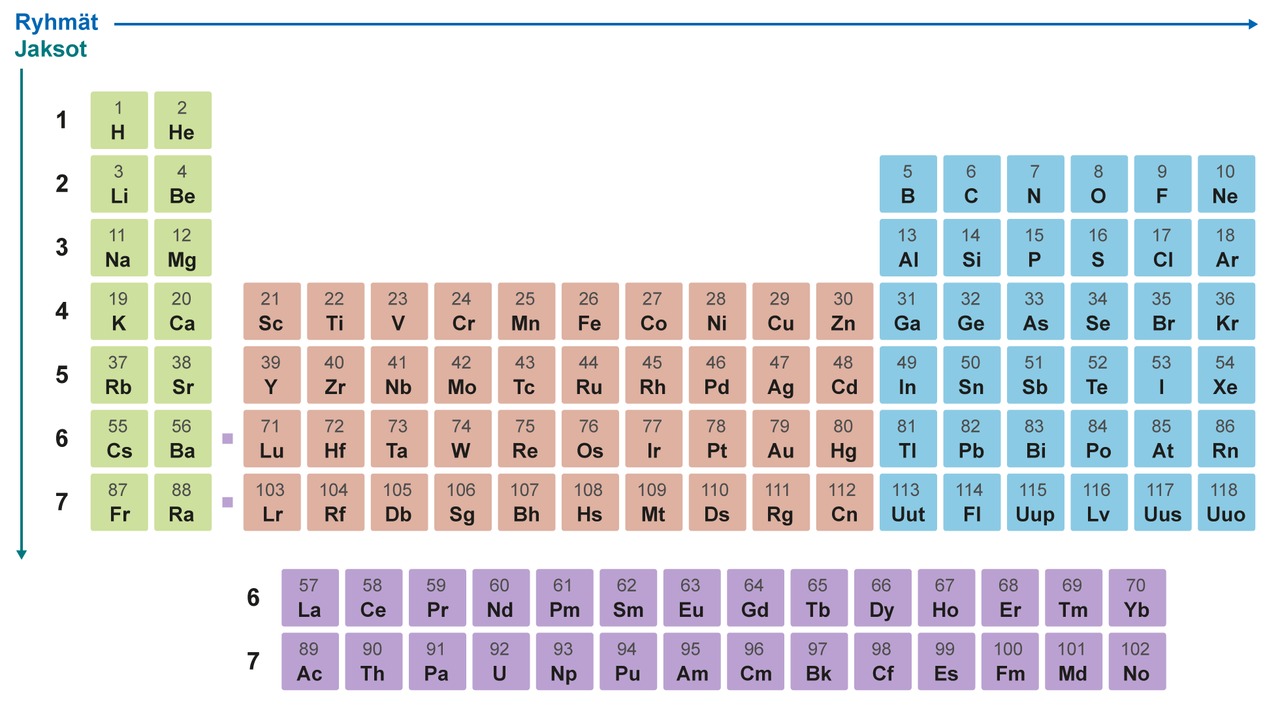
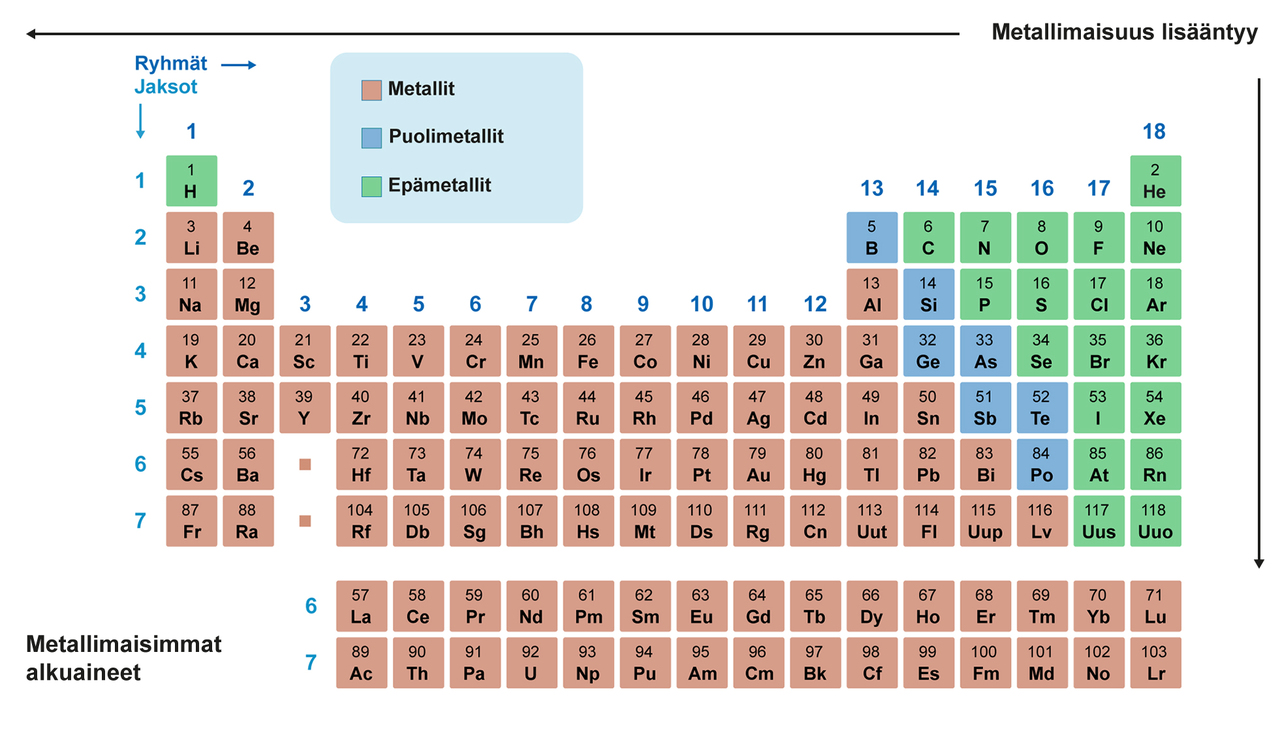
Pysty- ja vaakarivit on numeroitu. Ryhmiä on 18 ja jaksoja seitsemän. Ryhmiä 1, 2 ja 13−18 sanotaan pääryhmiksi, joille on annettu myös omat nimet. Muut alkuaineet kuuluvat sivuryhmiin. Jaksoja ei ole nimetty. Ensimmäiseen jaksoon kuuluu kaksi alkuainetta vety ja helium ja toiseen jaksoon kahdeksan alkuainetta litiumista neoniin.

2. Ryhmäominaisuudet
Atomin uloimman energiatason elektronirakenne määrää alkuaineen kemialliset ominaisuudet. Saman ryhmän alkuaineilla on samankaltaiset kemialliset ominaisuudet, koska niillä on samanlainen uloimman energiatason elektronirakenne.
Pääryhmien 1 ja 2 alkuaineilla ryhmän numero ilmaisee suoraan atomin uloimmalla energiatasolla olevien elektronien eli ulkoelektronien lukumäärän. Ryhmien 13–18 kohdalla ulkoelektronien lukumäärän voi päätellä jälkimmäisestä numerosta. Esimerkiksi ryhmän 1 alkuaineilla on yksi ulkoelektroni ja ryhmän 15 alkuaineilla viisi ulkoelektronia. Sivuryhmien alkuaineiden atomeilla on uloimmalla energiatasolla 1−3 elektronia, eikä niiden määrää voi päätellä ryhmän numerosta.
Atomin koko kasvaa ryhmässä ylhäältä alaspäin. Metalleissa suurikokoisesta atomista on helpompi irrottaa ulkoelektroni kuin pienikokoisesta, sillä kaukana ytimestä olevan elektronin ja ytimen välisen vetovoiman kumoamiseen tarvitaan vähemmän energiaa. Tämän johdosta metallien reaktiivisuus lisääntyy ryhmässä ylhäältä alaspäin siirryttäessä.
Esimerkiksi litiumi on pieni atomi, jossa ulkoelektronit ovat lähellä ydintä ja siksi sen reaktio veden kanssa on melko rauhallinen. Natriumissa ulkoelektronien etäisyys on suurempi ja reaktio veden kanssa selvästi nopeampi. Cesiumin ulkoelektronit ovat näihin verrattuna selvästi kauempana ja sen reaktio veden kanssa vaarallisen kiivas.
Epämetallien reaktiivisuus vähenee ryhmässä ylhäältä alaspäin. Epämetalleilla uloimman energiatason elektronirakenne on vain hieman vajaa. Epämetallit ottavat helposti vastaan elektroneja. Pieni epämetalliatomi, jossa on suuri ydinvaraus, reagoi herkimmin. Esimerkiksi fluoriatomi on kooltaan pieni ja sillä on ytimessään yhdeksän protonia ja se reagoi herkästi.
Ryhmän 18 alkuaineet He, Ne, Ar, Kr, Xe ja Rn ovat jalokaasuja. Ne ovat kemiallisesti passiivisia. Passiivisuus osoittaa, että jalokaasuilla on muihin alkuaineisiin verrattuna erittäin pysyvä elektronirakenne. Monien muiden alkuaineiden reagoidessa niiden elektronirakenne muistuttaa jalokaasun elektronirakennetta reaktion jälkeen.
3. Jakso-ominaisuudet
Jaksollisen järjestelmän vaakarivit ovat jaksoja. Saman jakson alkuaineilla ulkoelektronit ovat samalla energiatasolla. Jaksosta toiseen siirtyminen merkitsee sitä, että ulkoelektronit sijoittuvat seuraavalle energiatasolle.
Ensimmäisen jakson alkuaineilla on elektroneja vain yhdellä energiatasolla, toisen jakson alkuaineilla elektroneja on kahdella energiatasolla, kolmannen jakson kolmella ja niin edelleen. Jaksossa vasemmalta oikealle siirryttäessä energiatasojen lukumäärä pysyy samana, mutta ulkoelektronien lukumäärä lisääntyy. Jakson ensimmäisellä alkuaineella ulkoelektronien lukumäärä on pienin mahdollinen ja jakson viimeisellä alkuaineella suurin mahdollinen.

Elektronien lukumäärät neljän ensimmäisen jakson pääryhmissä.
Samassa jaksossa pääryhmien alkuaineiden atomisäde pienenee vasemmalta oikealle, sillä kasvava ydinvaraus vaikuttaa elektronien sijoittumiseen ytimen ympärille.

Yksi tyypillisimmistä jaksossa muuttuvista ominaisuuksista on metallisuus. Esimerkiksi kolmannessa jaksossa natrium on metalli ja argon on epämetalli. Jaksollisessa järjestelmässä alkuaineiden kemiallisia ominaisuuksia havainnollistaan usein väreillä. Esimerkiksi alla olevassa taulukossa metallit kuvataan keskenään samalla taustavärillä, samoin epämetallit ja puolimetallit. Puolimetalleilla on sekä metallien että epämetallien ominaisuuksia.
4. Rakenna alkuaineita simulaatioilla
Tiivistelmä
- Jaksollisen järjestelmän pystyrivejä sanotaan ryhmiksi ja vaakarivejä jaksoiksi.
- Monet alkuaineiden ominaisuuksista muuttuvat säännöllisesti siirryttäessä jaksollisessa järjestelmässä jaksossa vasemmalta oikealle tai ryhmässä ylhäältä alas.
- Ryhmäominaisuudet: Atomin uloimman energiatason elektronirakenne määrää alkuaineen kemialliset ominaisuudet.
- Saman jakson alkuaineilla ulkoelektronit ovat samalla energiatasolla. Jaksosta toiseen siirtyminen merkitsee sitä, että ulkoelektronit sijoittuvat seuraavalle energiatasolle.