6. Kemiallinen reaktio
Hapen ja vedyn välinen kemiallinen reaktio
Happimolekyyli koostuu kahdesta happiatomista, jotka ovat kemiallisesti toisiinsa sitoutuneita. Tätä sidosta sanotaan kemialliseksi sidokseksi. Vastaavasti vetymolekyylissä kaksi vetyatomia on sitoutunut yhdellä kemiallisella sidoksella toisiinsa. Kun näitä molekyylejä sekoitetaan keskenään ja tuodaan vielä tarpeeksi lämpöenergiaa eli kuumennetaan niiden seosta, tapahtuu suorastaan räjähtävä kemiallinen muutos. Samalla energiaa vapautuu enemmän kuin mitä systeemiin alun perin tuotiin.
Happi- ja vetymolekyylien sidokset katkeavat ja uusia sidoksia syntyy. Atomit järjestyvät uudella tavalla, jolloin kaksi vetyatomia muodostavat kemiallisen sidoksen yhden happiatomin kanssa. Syntyy uusi molekyyli jossa on kahta eri alkuainetta, vetyä ja happea. On tapahtunut kemiallinen reaktio, koska aineet ovat muuttuneet toisiksi aineiksi.
Koska tässä uudessa molekyylissä on kaksi eri alkuainetta (H ja O) sitoutunut kemiallisesti toisiinsa, se on yhdiste, ei puhdas alkuaine.
Reaktioyhtälön kirjoittaminen
Kemiassa kemialliset reaktiot kuvataan reaktioyhtälöillä. Harjoitellaan reaktioyhtälön kirjoittamista hapen ja vedyn välisellä reaktiolla. Kemian reaktioyhtälöt kirjoitetaan seuraavasti: Kirjoitetaan vasemmalle lähtöaine tai -aineet, nuoli (→) väliin ja oikealle tuote tai tuotteet. Jos lähtöaineita tai tuotteita on useampi kuin yksi, niiden väliin laitetaan plus-merkki. Kemiallisessa reaktiossa ainetta ei voi hävitä mihinkään. Reaktioyhtälön tasapainottaminen siis edellyttää, että kunkin alkuaineen atomeja on nuolen molemmin puolin yhtä monta.
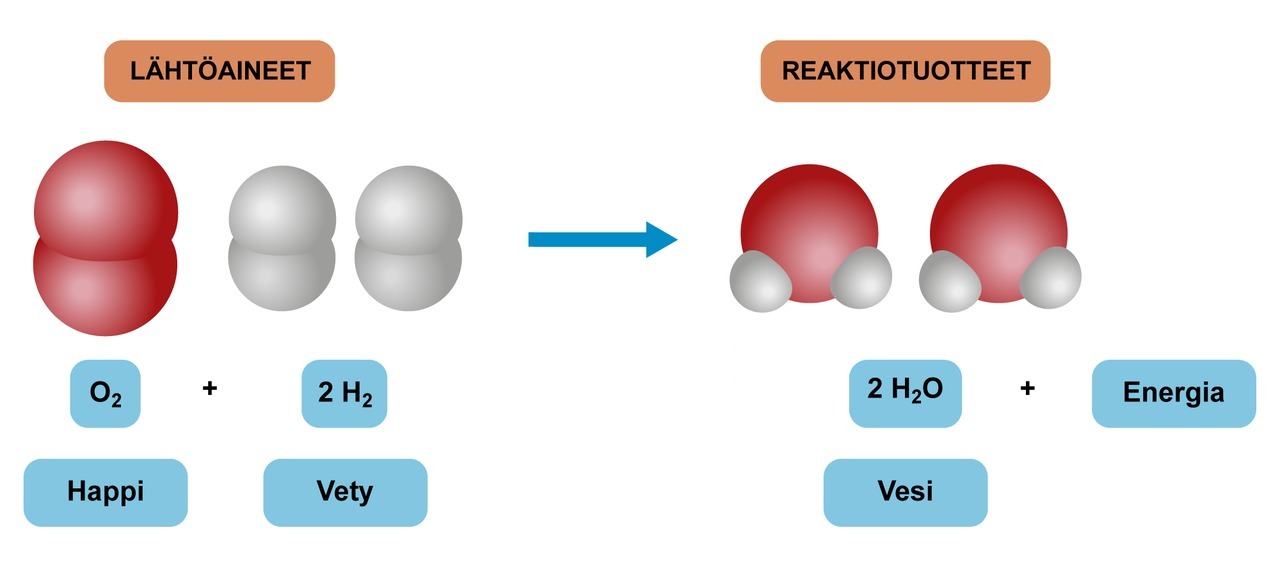

Energian vapautuminen ja sitoutuminen
Osa kemiallisista reaktioista tuottaa ympäristöönsä energiaa, kunhan ne ovat päässeet alkuun. Tästä hyvä esimerkki on nuotion poltto, kunhan puut ensin saadaan sytytettyä. Nuotion äärellä on hyvä lämmitellä, koska puuhun sitoutunutta kemiallista energiaa vapautuu polton yhteydessä lämpönä ympäristöön.

Toiset kemialliset reaktiot taas puolestaan sitovat energiaa ympäristöstään jäähdyttäen sitä samalla. Usein tosin fysikaaliset olomuodon muutokset ovat arkielämän kannalta käyttökelpoisempia keinoja viilentää vaikkapa ruoka-aineita (jääkaappi).

Tässä videossa nähdään ruokasoodan ja etikan välinen reaktio, jossa sitoutuu energiaa. Energiaa sitovat reaktiot ovat endotermisiä reaktioita ja energiaa vapauttavat ovat eksotermisiä reaktioita.

Toiset kemialliset reaktiot taas puolestaan sitovat energiaa ympäristöstään jäähdyttäen sitä samalla. Usein tosin fysikaaliset olomuodon muutokset ovat arkielämän kannalta käyttökelpoisempia keinoja viilentää vaikkapa ruoka-aineita (jääkaappi).

Tässä videossa nähdään ruokasoodan ja etikan välinen reaktio, jossa sitoutuu energiaa. Energiaa sitovat reaktiot ovat endotermisiä reaktioita ja energiaa vapauttavat ovat eksotermisiä reaktioita.