Metallisidos
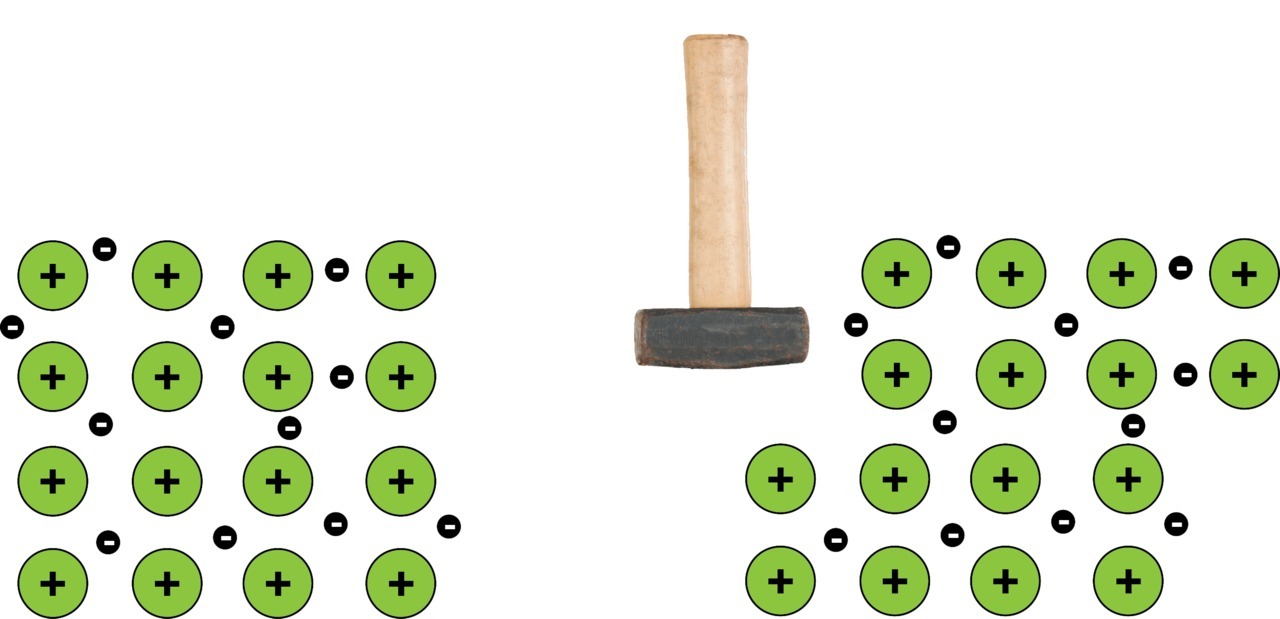
Useimmilla metalleilla on atomin uloimmalla elektronikuorella vain 1 - 3 elektronia, jotka irtoavat herkästi ja muodostavat metallikappaleeseen ns. elektronimeren. Tämä vapaasti liikkuvien elektronien meri muodostaa liiman, joka on kaikkien atomeista muodostuneiden positiivisten metalli-ionien yhteisessä käytössä ja pitää nämä metalli-ionit tiukasti kiinni toisissaan. Näin näistä metalli-ioneista muodostuu säännöllinen kiderakenne ja syntynyttä kemiallista sidosta kutsutaan metallisidokseksi.
Huomaa, että metallikappaleessa kokonaisuudessaan elektronien ja protonien määrä pysyy samana, joten metallit ovat alkuainemuodossaan sähköisesti neutraaleja.
Huomaa myös ero ennestään tuttuihin molekyyli- ja ionisidoksiin, joissa yhteisesti muodostettu elektronipari on joko kahden atomin yhteiskäytössä (molekyylisidos) tai tämä elektronipari on siirtynyt toiselta atomilta käytännössä kokonaan toiselle atomille (ionisidos). Metallisidoksen yhteydessä ei voida puhua elektroniparista, vaan valtavasta määrästä yhteisiä ja liikkuvia elektroneja.
Huomaa, että metallikappaleessa kokonaisuudessaan elektronien ja protonien määrä pysyy samana, joten metallit ovat alkuainemuodossaan sähköisesti neutraaleja.
Huomaa myös ero ennestään tuttuihin molekyyli- ja ionisidoksiin, joissa yhteisesti muodostettu elektronipari on joko kahden atomin yhteiskäytössä (molekyylisidos) tai tämä elektronipari on siirtynyt toiselta atomilta käytännössä kokonaan toiselle atomille (ionisidos). Metallisidoksen yhteydessä ei voida puhua elektroniparista, vaan valtavasta määrästä yhteisiä ja liikkuvia elektroneja.
