5. Reaktioyhtälö
Reaktioyhtälön tasapainottaminen
Kemiassa kemialliset reaktiot kuvataan reaktioyhtälöillä. Reaktioyhtälöstä nähdään aina:
- Reaktioon osallistuvat aineet
- Reaktiossa syntyvät aineet
- Reaktion suunnan
- Aineiden suhteen reaktiossa
Kemian reaktioyhtälöt kirjoitetaan seuraavasti:
- Reaktioon osallistuvat aineet
- Reaktiossa syntyvät aineet
- Reaktion suunnan
- Aineiden suhteen reaktiossa
Kemian reaktioyhtälöt kirjoitetaan seuraavasti:
- Kirjoitetaan vasemmalle lähtöaine tai -aineet, nuoli ([[$ \rightarrow $]]) väliin ja oikealle tuote tai tuotteet.
- Jos lähtöaineita tai tuotteita on useampi kuin yksi, niin niiden väliin laitetaan + -merkki:
Esimerkki: Hapen ja vedyn välisestä reaktiosta syntyy vettä.
[[$ \text{vety}+\text{happi}\rightarrow \text{vesi} $]]
Sama kemiallisin merkein:
[[$ \text{H}_{2}+\text{O}_{2}\rightarrow \text{H}_{2}\text{O} $]]
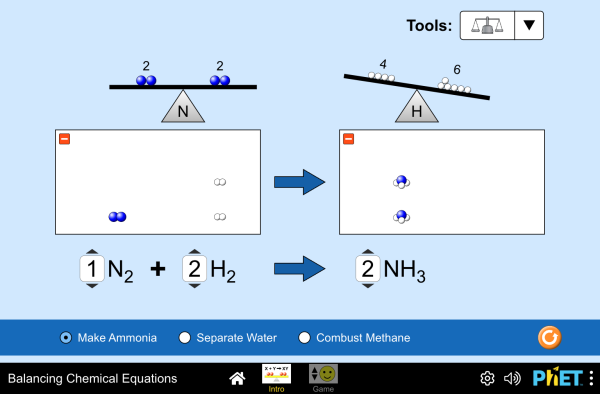
Reaktioyhtälöä tasapainotettaessa on voimassa aineen häviämättömyyden periaate. Tämä tarkoittaa sitä, että lähtöaineiden puolella on yhtä monta kunkin alkuaineen atomia kuin on lopputuotteiden puolella. Yhtään atomia ei siis saa ilmestyä tyhjästä eikä yhtään atomia voi kadota matkan varrella.
Reaktioyhtälön tasapainottaminen siis edellyttää, että kunkin alkuaineen atomeja on nuolen molemmin puolin yhtä monta. Vetyatomeja on kyllä molemmin puolin kaksi, mutta happiatomeja on lähtöaineiden puolella kaksi ja tuotteiden puolella vain yksi. Näin voit tasapainottaa tämän reaktioyhtälön:
Reaktioyhtälön tasapainottaminen siis edellyttää, että kunkin alkuaineen atomeja on nuolen molemmin puolin yhtä monta. Vetyatomeja on kyllä molemmin puolin kaksi, mutta happiatomeja on lähtöaineiden puolella kaksi ja tuotteiden puolella vain yksi. Näin voit tasapainottaa tämän reaktioyhtälön:
[[$ 2\text{ H}_{2}+\text{O}_{2}\rightarrow 2 \text{ H}_{2}\text{O} $]]
Voit harjoitella reaktioyhtälöiden tasapainottamista myös tällä
Harjoittele
Energian vapautuminen ja sitoutuminen
Osa kemiallisista reaktioista tuottaa ympäristöönsä energiaa, kunhan ne ovat päässeet alkuun. Tästä hyvä esimerkki on nuotion poltto, kunhan puut ensin saadaan sytytettyä. Nuotion äärellä on hyvä lämmitellä, koska puuhun sitoutunutta kemiallista energiaa vapautuu polton yhteydessä lämpönä ympäristöön. Tällaista reaktiota kutsutaan eksotermiseksi reaktioksi
Toiset kemialliset reaktiot taas puolestaan sitovat energiaa ympäristöstään jäähdyttäen sitä samalla. Urheiluvammojen hoitoon käytettävä kylmäpussi on hyvä esimerkikki tällaisesta reaktiosta. Kylmäpussin sisällä on ammoniumnitraattia ja ohuesta muovista valmistettu vesipussi. Kun päällipussia puristetaan, rikkoutuu vesipussi. Tällöin syntyy kemiallinen reaktio, joka sitoo energiaa eli pussi kylmenee alle 0 asteiseksi.Tällaista reaktiota kutsutaan endotermiseksi reaktioksi.
Tässä videossa nähdään ruokasoodan ja etikan välinen reaktio, jossa sitoutuu energiaa. Energiaa sitovat reaktiot ovat endotermisiä reaktioita ja energiaa vapauttavat ovat eksotermisiä reaktioita.
Toiset kemialliset reaktiot taas puolestaan sitovat energiaa ympäristöstään jäähdyttäen sitä samalla. Urheiluvammojen hoitoon käytettävä kylmäpussi on hyvä esimerkikki tällaisesta reaktiosta. Kylmäpussin sisällä on ammoniumnitraattia ja ohuesta muovista valmistettu vesipussi. Kun päällipussia puristetaan, rikkoutuu vesipussi. Tällöin syntyy kemiallinen reaktio, joka sitoo energiaa eli pussi kylmenee alle 0 asteiseksi.Tällaista reaktiota kutsutaan endotermiseksi reaktioksi.
Tässä videossa nähdään ruokasoodan ja etikan välinen reaktio, jossa sitoutuu energiaa. Energiaa sitovat reaktiot ovat endotermisiä reaktioita ja energiaa vapauttavat ovat eksotermisiä reaktioita.