3. Kemiaa ja sähköä
Kemiaa ja sähköä
Sähköä voidaan tuottaa mekaanisesti voimaloissa, joissa pyörivät generaattorit saavat sähkövirran aikaan magneettien avulla. Mutta miten älypuhelin saa tarvitsemansa sähkövirran vaikka siinä ei ole liikkuvia osia?
Sähkö on varattujen hiukkasten (elektronien) liikettä. Usein metalliatomeilla on 1-3 ulkoelektronia, joista atomit haluavat päästä eroon. Jos eri metallien välille saataisiin jatkuvaa elektronien liikettä, niin saataisiin aikaan myös sähköä.
Toiset metallit ovat halukkaampia luopumaan ulkoelektroneistaan kuin toiset. Metallit jaetaan jaloihin ja epäjaloihin metalleihin niiden elektronien luovutuskyvyn mukaisesti. Mitä jalompi metalli on, niin sitä haluttomampi se on luopumaan elektroneistaan. Mitä epäjalompi metalli on, niin sitä helpommin se luopuu elektroneistaan ja muuttuu ioniksi.
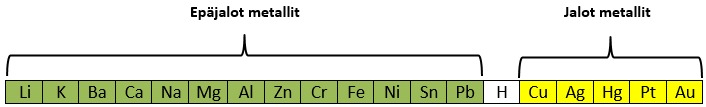
Metallien sähkökemiallinen jännitesarja jakaa metallit jaloihin ja epäjaloihin metalleihin. Vety jakaa metallit kahteen osaan, sillä epäjalot metallit reagoivat suolahapon [[$HCl$]] kanssa, mutta jalot metallit eivät.
Valitsemalla kaksi eri metallia ja laittamalla ne sähköä johtavaan liuokseen saadaan aikaiseksi elektronien liikettä. Syntyy niin kutsuttu sähköpari, eli laite jossa kemiallinen energia muutetaan sähköksi.

Pariston sisältämä kemiallinen energia muutttuu sähköksi kun paristo muodostaa lampun kanssa virtapiirin.
Sähkö on varattujen hiukkasten (elektronien) liikettä. Usein metalliatomeilla on 1-3 ulkoelektronia, joista atomit haluavat päästä eroon. Jos eri metallien välille saataisiin jatkuvaa elektronien liikettä, niin saataisiin aikaan myös sähköä.
Toiset metallit ovat halukkaampia luopumaan ulkoelektroneistaan kuin toiset. Metallit jaetaan jaloihin ja epäjaloihin metalleihin niiden elektronien luovutuskyvyn mukaisesti. Mitä jalompi metalli on, niin sitä haluttomampi se on luopumaan elektroneistaan. Mitä epäjalompi metalli on, niin sitä helpommin se luopuu elektroneistaan ja muuttuu ioniksi.

Metallien sähkökemiallinen jännitesarja jakaa metallit jaloihin ja epäjaloihin metalleihin. Vety jakaa metallit kahteen osaan, sillä epäjalot metallit reagoivat suolahapon [[$HCl$]] kanssa, mutta jalot metallit eivät.
Valitsemalla kaksi eri metallia ja laittamalla ne sähköä johtavaan liuokseen saadaan aikaiseksi elektronien liikettä. Syntyy niin kutsuttu sähköpari, eli laite jossa kemiallinen energia muutetaan sähköksi.

Pariston sisältämä kemiallinen energia muutttuu sähköksi kun paristo muodostaa lampun kanssa virtapiirin.
Elektrolyysi on sähköparille päinvastainen ilmiö. Siinä sähkövirralla tuotetaan kemiallista energiaa. Esimerkiksi akkua ladattaessa akun napoihin johdetaan sähkövirta, joka saa aikaan hapettumista positiivisella navalla ja pelkistymistä negatiivisella navalla.

Auton akku toimii käytettäessä sähköparina ja sitä ladattaessa elektrolyysikennona.