Lämpöoppi
Lämpö ja energian siirtyminen
Lämpö ja lämpömäärä
Lämmön siirtyminen
Lämpösäteilystä
- Mikrotasolla lämmöllä tarkoitetaan hiukkasten liikeen energiaa.
- Makrotasolla lämmöllä tarkoitetaan yksinkertaisesti lämpöenergiaa.
- Lämpömäärä Q tarkoittaa siirtyneen lämpöenergian määrää [Q] = J.
Lämmön siirtyminen
- Lämpö siirtyy kylmästä lämpimään ja lämpötilaerot tasoittuvat.
- Mikrotasolla tämä tarkoittaa sitä, että hiukkasten liike-energiaerot tasoittuvat.
- Kuljettuminen: lämpö siirtyy aineen mukana. Esimerkiksi kylmään veteen kaadetaan kuumaa vettä. Lämpimän aine kulkeutuu kylmän sekaan ja sekoittuu.
- Johtuminen: lämpö siirtyy kappaleen sisällä tai kappaleiden rajapinnassa; lämpö siirtyy, mutta itse aine ei siirry. Esimerkiksi vesi kattilassa lämpenee, kun lämpö johtuu kattilan mettalimolekyyleistä vesimolekyyleihin.
- Säteily: lämpö siirtyy sähkömagneettisena säteilynä. Ei tarvita ainetta lämmön välittäjänä. Esimerkiksi auringosta tuleva infrapunasäteily.
- Jos ainetta ei ole, ei lämpö voi johtua. Esim. termospullo.
- Lämmönjohtavuus tarkoittaa aineen kykyä johtaa lämpöä.
- Metallit johtavat lämpöä hyvin.
Lämpösäteilystä
- Kaikessa aineessa on hiukkasten liikettä ja kaikki aine säitelee.
- Lämpösäteily syntyy mikrotason varattujen hiukkasten värähtelystä ja vuorovaikutuksesta.
- Jos liike loppuu, säteily loppuu. Tämä tosin on mahdollista vain absoluuttisessa nollapisteessä.
- Lämpöopin kolmas perussääntö sanoo, että absoluuttista nollapistettä ei voida käytännössä saavutta.
- Kun kappaletta lämmitetään, sen lähettämä säteily lisääntyy ja säteilyn keskimääräinen aallonpituus lyhenee.
- Sähkömagneettinen säteily - erityisesti infrapuna-, eli lämpösäteily lämmittää ainetta.
- Säteily saa aineen hiukkaset liikkumaan (värähtelemään), eli aine lämpenee.
- Lämpösäteily siirtää energiaa lähteestään kohteeseen.
Lämpöopin pääsäännöt
Ensimmäinen pääsääntö: energian säilyminen
Toinen pääsääntö: entropia kasvaa
Kolmas pääsääntö: absoluuttista nollapistettä ei voida saavuttaa
- Energiaa ei voida hävittää, se vain muuttaa muotoaan.
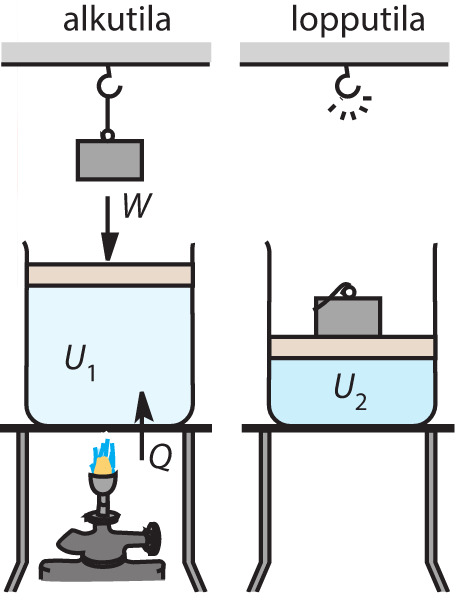
- Termodynaamiseen systeemiin voidaan tuoda energiaa kahdessa eri muodossa työnä W ja lämpönä Q.
- Tuotu energia muuttuu systeemin sisäenergiaksi U.
- Sisäenergian muutos on siis systeemiin tuodun energian määrä:
- Sisäenergian muutos ilmenee muutoksena systeemin lämpötilassa, paineessa, tilavuudessa tai olomuodossa.
- Systeemistä voi myös lähteä energiaa. Tällöin systeemi, joko luovuttaa lämpömäärän -Q tai tekee ympäristölle työn -W. Huomaa miinus merkki energian lähtiessä systeemistä.
Toinen pääsääntö: entropia kasvaa
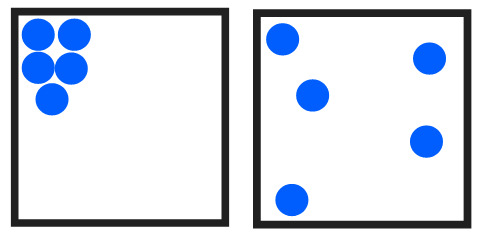
- Suljettu systeemi pyrkii kohti suurimman todennäköisyyden tilaa.
- Esimerkiksi: kaasun molekyylit voivat olla missä tahansa systeemin sisällä. On hyvin epätodennäköistä, että ne löytyvät juuri samasta nurkasta. Entropian lain mukaan systeemi pyrkii tilaan, jossa molekyylit ovat melko tasaisesti jakautuneet ympäri systeemiä, koska sen todennäköisyys on suurin.
- Systeemin entropian kasvaessa sen epäjärjestys kasvaa ja sen kyky tehdä työtä vähenee, eli sen vapaa energia vähenee.
- Lämpöenergiaa ei voi koskaan täysin muuttaa työksi.
Kolmas pääsääntö: absoluuttista nollapistettä ei voida saavuttaa