2. Alkuaineet taulukoksi
1. Virittäytyminen – alkuaineet taulukoon
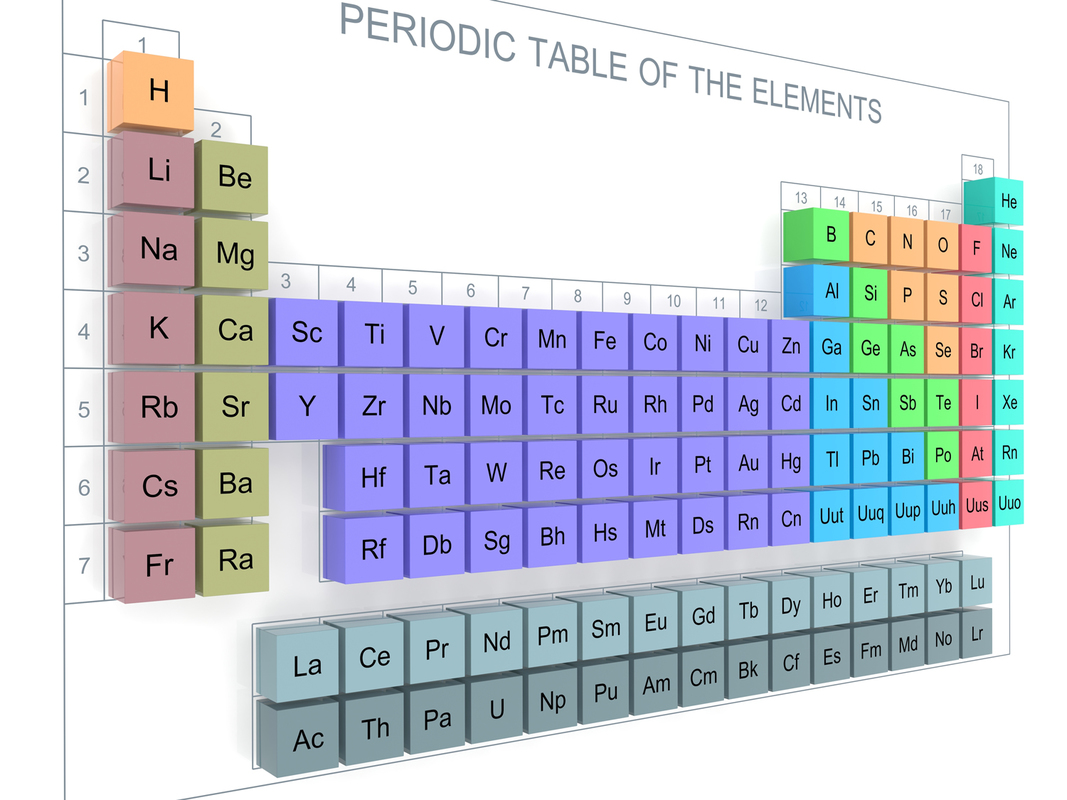
![]() Alkuaineet on järjestetty taulukkomuotoon, jota kutsutaan jaksolliseksi järjestelmäksi. Keskustelkaa järjestelmästä parin kanssa lyhyesti:
Alkuaineet on järjestetty taulukkomuotoon, jota kutsutaan jaksolliseksi järjestelmäksi. Keskustelkaa järjestelmästä parin kanssa lyhyesti:
- Oletteko ikinä kuulleet alkuaineiden jaksollisesta järjestelmästä?
- Jos olette, niin missä yhteydessä?
- Muistatteko, mitä asioita sen avulla voi päätellä aineiden ominaisuuksista?
2. Jaksollisen järjestelmän keksiminen
Kemian tutkimuksen pioneeriaikoina 1700- ja 1800 -luvuilla löydettiin paljon uusia alkuaineita. Vertailevien kokeiden perusteella huomattiin tiettyä säännönmukaisuutta eri aineiden kemiallisissa ominaisuuksissa. Havainnot johtivat ajatukseen, että alkuaineet voitaisiin asettaa järjestykseen kemiallisten ominaisuuksiensa perusteella.
Aluksi ryhmittelyn perustana käytettiin atomimassoja, vanhalta nimitykseltään atomipainoja. Ne saatiin selville vertaamalla eri alkuaineiden ja niiden yhdisteiden reaktioita ja reaktioon osallistuvien aineiden massasuhteita. Kaikkien aineiden massojen vertailu osoittautui lopulta mahdottomaksi, sillä erilaisia yhdisteitä on lukematon määrä. Tämän vuoksi yritettiin löytää jokin sopiva alkuaine, jonka massaan muiden alkuaineiden massoja voitaisiin verrata.
 1800-luvun alkupuolella saksalainen Johann Wolfgang Döbereiner (1780−1849) (kuva oikealla) esitti, että eräät kemiallisilta ominaisuuksiltaan samankaltaiset alkuaineet voitiin ryhmitellä kolmittain niin sanotuiksi triadeiksi. Triadissa kahden jäsenen atomipainojen keskiarvo oli jokseenkin kolmannen alkuaineen atomipainon suuruinen.
1800-luvun alkupuolella saksalainen Johann Wolfgang Döbereiner (1780−1849) (kuva oikealla) esitti, että eräät kemiallisilta ominaisuuksiltaan samankaltaiset alkuaineet voitiin ryhmitellä kolmittain niin sanotuiksi triadeiksi. Triadissa kahden jäsenen atomipainojen keskiarvo oli jokseenkin kolmannen alkuaineen atomipainon suuruinen.
Myöhemmin vuosisadan puolivälin tienoilla englantilainen John Alexander Reina Newlands (1837−1898) esitti, että kasvavan atomipainon mukaan järjestetyistä alkuaineista joka kahdeksannella oli keskenään samankaltaisia kemiallisia ominaisuuksia samaan tapaan kuin musiikissa sävelillä sävelasteikolla. Hän nimitti ilmiötä oktaavilaiksi.
Tätä palapeliä yritettiin koota monella tavalla, kunnes venäläinen kemisti Dmitri Mendelejev ymmärsi jättää tyhjiä aukkoja omaan järjestelmäänsä. Hän ennusti, että aukot kuuluvat alkuaineille, joita ei vielä ollut löydetty mutta jotka tullaan löytämään myöhemmin. Lopulta tyhjät paikat saatiin täytettyä, mikä osoitti Mendelejevin olleen oikeassa.

Valokuva Dmitri Mendelejevistä vuodelta 1897.
Varhainen taulukko on pääpiirteittäin edelleen käytössä, vaikka mittaukset suoritettiin paljon nykyajan laitteita alkeellisimmilla menetelmillä. Taulukkoa on sittemmin täydennetty uusien tutkimustulosten myötä.

Mendelejevin alkuperäinen alkuainetaulukko vuodelta 1871. Huomaa taulukossa esitetyt tyhjät viivat, jotka esittävät vuonna 1871 tuntemattomia alkuaineita.
Taulukkoa kutsutaan nykyisin alkuaineiden jaksolliseksi järjestelmäksi. Siitä löytyy valtavasti kemiallista tietoa, kunhan sitä oppii tulkitsemaan. Jaksollisesta järjestelmästä on monia eri esitystapoja.
![]() Jaksollisen järjestelmän esitystapoja
Jaksollisen järjestelmän esitystapoja
3. Alkuaineiden järjestys perustuu ytimen protonien lukumäärään
Nykyisessä jaksollisessa järjestelmässä alkuaineet ovat peräkkäin kasvavan järjestysluvun Z perusteella. Järjestysluku on ytimessä olevien protonien lukumäärä. Näin muodostettu järjestys poikkeaa vain muutaman alkuaineen kohdalla Mendelejevin versiosta.

Heliumatomissa on kaksi protonia. Heliumin järjestysluku on siis 2.
Jaksollinen järjestelmä pitää sisällään monipuolista tietoa alkuaineen rakenteesta ja sen kemiallisista ominaisuuksista. Alkuaineen tunnus eli sen kemiallinen merkki kirjoitetaan kirjaimilla ja merkitään laatikkoon. Kemiallisen merkin yläpuolella oleva luku on kyseisen aineen järjestysluku eli ytimessä olevien protonien lukumäärä. Kemiallisen merkin alapuolella oleva luku on kyseisen alkuaineen atomimassa. Atomimassaa kutsutaan massaluvuksi.

Tiivistelmä
- Alkuaineiden jaksollinen järjestelmä on taulukko tunnetuista alkuaineista ryhmiteltynä niiden elektronirakenteen mukaan.
- Jaksollinen järjestelmä keksittiin 1800-luvun lopussa. Sen keksijäksi on tunnustettu venäläinen superkemisti Dmitri Mendelejev.
- Järjestysluku ilmaisee ytimessä olevien protonien lukumäärän.