Kpl.4.1
4.1
a) Hapettuminen
b) Pelkistyminen
c) Pelkistyminen
d) Pelkistyminen
e) Hapettuminen
4.2
A-4 Pelkistyminen
B-1 Hapettuminen
C-2 Hapettuminen
D-3 Pelkistyminen
4.3
a)

Metanaali ja metaanihappo
b)

1-Propanoli
c)
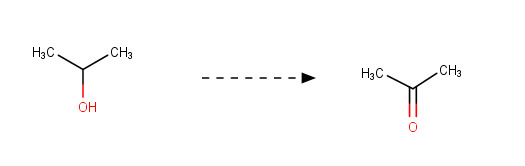
2-Probanoni
d)
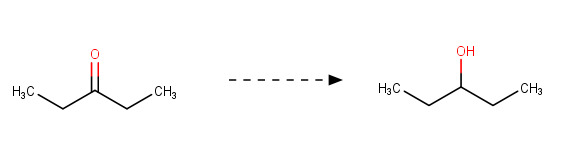
3-pentanoli
e)
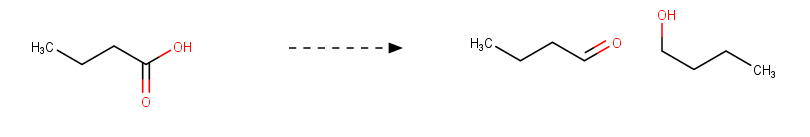
Butanaali ja 1-butanoli
4.4
a)

b)

c)
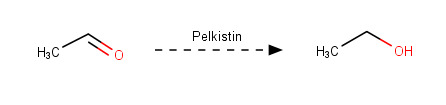
d)

4.5

A: 2-metyylibutanaali
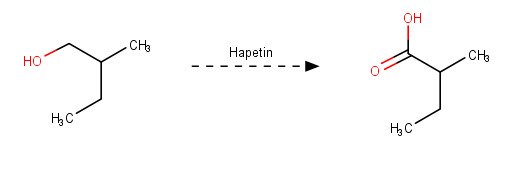
B: 2-metyyli-1-butanoli
C: 2-metyylibutaanihappo

Yhdisteen D muodostumisreaktio on neutraloitumisreaktio
4.6
m-%(C) = 68,4 %
m-%(H) = 11,4 %
m-%(O) = 20,2 %
Ratkaistaan ensin yhdisteen X suhde- eli empiirinen kaava olettaen, että yhdistettä on 100 grammaa.
Tämä massa sisältää massaprosenttisen koostumuksen perusteella eri alkuaineita seuraavasti:
m(C) = 68,4 g
m(H) = 11,4 g
m(O) = 20,2 g
Ratkaistaan alkuaineatomien ainemäärä:
%3D%5Cfrac%7Bm%5Cleft(C%5Cright)%7D%7BM%5Cleft(C%5Cright)%7D%3D%5Cfrac%7B68%7B%2C%7D4g%7D%7B12%7B%2C%7D01%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D5%7B%2C%7D6953mol)
%3D%5Cfrac%7Bm%5Cleft(H%5Cright)%7D%7BM%5Cleft(H%5Cright)%7D%3D%5Cfrac%7B11%7B%2C%7D4g%7D%7B1%7B%2C%7D008%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D11%7B%2C%7D310mol)
%3D%5Cfrac%7Bm%5Cleft(O%5Cright)%7D%7BM%5Cleft(O%5Cright)%7D%3D%5Cfrac%7B20%7B%2C%7D2g%7D%7B16%7B%2C%7D00%5Cfrac%7Bg%7D%7Bmol%7D%7D%3D1%7B%2C%7D2625mol)
Jaetaan kukin ainemäärä pienimmällä (hapen) ainemäärällä, jolloin ainemäärien suhteeksi saadaan
n(C) : n(H) : n(O) = 4,50 : 8,96: 1.
Tästä saadaan pienimpien kokonaislukujen suhteeksi 9:18:2 kertomalla kukin luku kahdella.
Yhdisteen X suhdekaava on siten (C9H18O2)x.
Lasketaan x:n arvo lausekkeesta x ∙ (9 ∙ 12,01 + 18 ∙ 1,008 + 2 ∙ 16,00) = 158, josta 158,23 x = 158 => x = 1.
Yhdisteen X molekyylikaava on siten C9H18O2.
Koska yhdisteessä on kaksi happiatomia, kyseessä voi olla karboksyylihappo tai esteri. Tiedetään, että yhdiste pelkistyy, jolloin syntyy yhdistettä Y, jossa IR-tutkimuksen mukaan on alkoholeille tyypillinen hydroksyyliryhmä. Eli pelkistymisreaktiossa on muodostunut alkoholia. X:n tulee siten olla karboksyylihappo, joka pelkistyy primääriseksi alkoholiksi.
Yhdisteen X rakennekaava on

Yhdisteen Y rakennekaava on
a) Hapettuminen
b) Pelkistyminen
c) Pelkistyminen
d) Pelkistyminen
e) Hapettuminen
4.2
A-4 Pelkistyminen
B-1 Hapettuminen
C-2 Hapettuminen
D-3 Pelkistyminen
4.3
a)

Metanaali ja metaanihappo
b)

1-Propanoli
c)

2-Probanoni
d)

3-pentanoli
e)

Butanaali ja 1-butanoli
4.4
a)

b)

c)

d)

4.5

A: 2-metyylibutanaali

B: 2-metyyli-1-butanoli
C: 2-metyylibutaanihappo

Yhdisteen D muodostumisreaktio on neutraloitumisreaktio
4.6
m-%(C) = 68,4 %
m-%(H) = 11,4 %
m-%(O) = 20,2 %
Ratkaistaan ensin yhdisteen X suhde- eli empiirinen kaava olettaen, että yhdistettä on 100 grammaa.
Tämä massa sisältää massaprosenttisen koostumuksen perusteella eri alkuaineita seuraavasti:
m(C) = 68,4 g
m(H) = 11,4 g
m(O) = 20,2 g
Ratkaistaan alkuaineatomien ainemäärä:
Jaetaan kukin ainemäärä pienimmällä (hapen) ainemäärällä, jolloin ainemäärien suhteeksi saadaan
n(C) : n(H) : n(O) = 4,50 : 8,96: 1.
Tästä saadaan pienimpien kokonaislukujen suhteeksi 9:18:2 kertomalla kukin luku kahdella.
Yhdisteen X suhdekaava on siten (C9H18O2)x.
Lasketaan x:n arvo lausekkeesta x ∙ (9 ∙ 12,01 + 18 ∙ 1,008 + 2 ∙ 16,00) = 158, josta 158,23 x = 158 => x = 1.
Yhdisteen X molekyylikaava on siten C9H18O2.
Koska yhdisteessä on kaksi happiatomia, kyseessä voi olla karboksyylihappo tai esteri. Tiedetään, että yhdiste pelkistyy, jolloin syntyy yhdistettä Y, jossa IR-tutkimuksen mukaan on alkoholeille tyypillinen hydroksyyliryhmä. Eli pelkistymisreaktiossa on muodostunut alkoholia. X:n tulee siten olla karboksyylihappo, joka pelkistyy primääriseksi alkoholiksi.
Yhdisteen X rakennekaava on

Yhdisteen Y rakennekaava on
